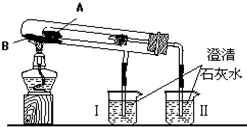
题目内容
11. CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:(1)一定温度下,在一体积为VL的密闭容器中充入一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=a mol、n(NO)=2a mol、n(N2)=b mol,且N2占平衡混合气体总价体积的$\frac{1}{4}$.
①该反应的平衡常数K=$\frac{27V}{a}$(用只含a、V的式子表示)
②判断该反应达到平衡的标志是BD(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
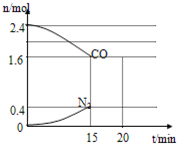
在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则
①有害气体NO的转化率是40%,0~15min CO2的平均反应速率v(CO2)=0.027mol/(L•min)(保留小数点后三位).
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是CD(填序号)
A.增加CO2的量 B.加入催化剂 C.降低温度 D.扩大容积体积.
分析 (1)①平衡时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,则根据方程式可知生成CO2是2bmol.又因为N2占平衡混合气体总体积的$\frac{1}{4}$,所以平衡时混合气体的总的物质的量是4b mol,则4bmol=bmol+2bmol+amol+2amol,解得b=3a,再由平衡常数表达式K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$计算;
②可逆反应到达平衡时,正逆反应速率相等,反应各组分的浓度、含量不变,由此衍生的其它物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化,说明到达平衡;
(2)①发生反应:2NO+2CO=N2+2CO2,计算消耗CO物质的量,根据方程式计算消耗NO物质的量,进而计算NO转化率;根据v=$\frac{△c}{△t}$计算v(N2),再利用速率之比等于化学计量数之比计算v(CO2);
②20min时,若改变反应条件,导致CO浓度减小,可以使平衡向正反应方向移动,不能增大CO浓度、不能增大压强,否则到达平衡时CO浓度会增大,也可以扩大容器体积.
解答 解:(1)①平衡时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,则根据方程式可知生成CO2是2bmol.又因为N2占平衡混合气体总体积的$\frac{1}{4}$,所以平衡时混合气体的总的物质的量是4b mol,则4bmol=bmol+2bmol+amol+2amol,解得:b=3a,再由平衡常数表达式K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$=$\frac{\frac{3a}{V}×({\frac{6a}{V})}^{2}}{(\frac{2a}{V})^{2}×(\frac{a}{V})^{2}}$=$\frac{27V}{a}$,
故答案为:$\frac{27V}{a}$;
②A.v(CO2)生成=v(CO)消耗,均表示正反应速率,所以不能说明反应达到平衡状态,故A错误;
B.混合气体总质量不变,但物质的量是变化的,因此混合气体的平均相对分子质量不再改变可以说明反应达到平衡状态,故B正确;
C.在反应过程中气体总质量和容积始终是不变的,因此密度始终是不变的,则混合气体的密度不再改变不能说明反应达到平衡状态,故C错误;
D.NO、CO、N2、CO2的物质的量浓度均不再变化,说明正逆反应速率相等,反应达到平衡状态,故D正确,
故答案为:BD;
(2)①发生反应:2NO+2CO=N2+2CO2,平衡时CO是1.6mol,则消耗CO是2.4mol-1.6mol=0.8mol,根据方程式可知消耗NO是0.8mol,因此有害气体NO的转化率是$\frac{0.8mol}{2.0mol}$×100%=40%,
v(N2)=$\frac{\frac{0.4mol}{2L}}{15min}$=$\frac{1}{75}$mol/(L.min),速率之比等于化学计量数之比,v(CO2)=2v(N2)=2×$\frac{1}{75}$mol/(L•min)=0.027mol/(L•min),
故答案为:40%;0.027mol/(L•min);
②A.增加CO的量,CO浓度增大,故A错误;
B.加入催化剂平衡不移动,CO浓度不变,故B错误;
C.减小CO2的量,平衡向正反应方向进行,CO浓度减小,故C正确;
D.扩大容积体积,压强减小,平衡虽然向逆反应方向进行,但平衡常数不变,CO浓度仍然减小,故D正确;
故答案为:CD.
点评 本题考查化学平衡有关计算、平衡状态判断、以及外界条件对平衡状态的影响等知识,是对学生综合能力的考查,题目难度中等,明确化学平衡及其影响因素为解答关键,试题培养了学生的分析能力及化学计算能力.


| A. | m+n<p+q△H>0 | B. | m+n>p+q△H>0 | C. | m+n<p+q△H<0 | D. | m+n>p+q△H<0 |
| A. | NaX的水溶液的碱性一定强于NaY水溶液的碱性 | |
| B. | HX一定是弱酸 | |
| C. | 反应结束时两者所用时间相同 | |
| D. | 浓度:C(HX)>C(HY) |
| A. | 新制氯水 | B. | 久置氯水 | C. | 氯化钠 | D. | 氯化氢 |
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3═2NaAlO2+CO2↑
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡Cr2O72-+H2O?2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-..
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
表是相关物质的溶解度数据:
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热浓缩、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
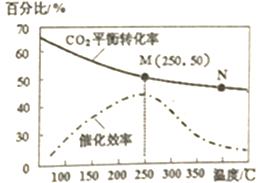 一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 平衡常数:KM<KN | |
| C. | 催化剂对CO2的平衡转化率没有影响 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |

 ②
②
 (请用化学方程式表达).
(请用化学方程式表达). 等(任写一种).
等(任写一种).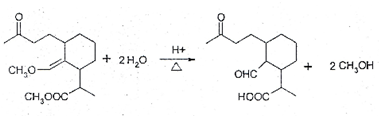 .
.