题目内容
5.表是周期表的一部分,其中X、Y、Z、W为短周期主族元素.下列说法正确的是( )| X | Y | ||
| Z | W |
| A. | W的最高价氧化物对应的水化物一定是强酸 | |
| B. | Z的单质一定能溶于稀硫酸中 | |
| C. | 四种元素的最高正化合价均等于其族序数 | |
| D. | 四种原子中,Z的原子半径最小 |
分析 X、Y、Z、W为短周期主族元素,根据元素周期表结构可知四种元素分别为C、N、Al、S或N、O、Si、Cl,据此结合元素周期律知识进行解答.
解答 解:X、Y、Z、W为短周期主族元素,根据元素周期表结构可知四种元素分别为C、N、Al、S或N、O、Si、Cl,
A.W可能为S或Cl,二者的最高价含氧酸分别为硫酸、高氯酸,都是强酸,故A正确;
B.Z可能为Al或Si元素,Al能与稀硫酸反应,但Si不与稀硫酸反应,故B错误;
C.Y可能为O元素,O元素没有正化合价,故C错误;
D.原子的电子层越大,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,则四种元素中Z的原子半径最大,故D错误;
故选A.
点评 本题考查位置结构与性质关系的应用,题目难度不大,明确元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期律的关系.

练习册系列答案
相关题目
15.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,其中只有一种金属元素,X是周期表中原子半径最小的元素,Y的最高正价与最低负价绝对值相等,W最外层电子数是最内层电子数的3倍,R是同周期元素中原子半径最小的元素.下列说法不正确的是( )
| A. | 原子半径Z>W>R | |
| B. | 对应的氢化物的热稳定性:R>W>Y | |
| C. | 单质Z可与R的最高价含氧酸发生置换反应 | |
| D. | W与R所形成的简单离子均能影响水的电离平衡 |
16.下列说法不正确的是( )
| A. | 煤的气化、液化和石油的分馏均为物理变化 | |
| B. | 蛋白质水解生成氨基酸的反应属于取代反应 | |
| C. | 丙烷与氯气反应可得到沸点不同的4 种二氯代物 | |
| D. | 乙酸和硬脂酸(C17H35COOH)互为同系物 |
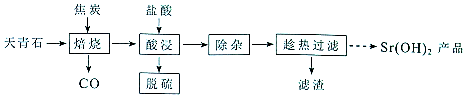
13.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3. MgO杂质)生产氢氧化锶的工艺如图:
已知氢氧化锶在水中的溶解度:
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12.
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=1.2×10-10.
②若pH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出.
(3)“趁热过滤”的目的是防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2.“滤渣”的主要成分为Mg(OH)2、Mg(OH)2.
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶或冷却结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCI3溶液吸收酸浸产生的气体,吸收时的氧化产物为S(填化学式):再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3.

已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12.
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=1.2×10-10.
②若pH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出.
(3)“趁热过滤”的目的是防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2.“滤渣”的主要成分为Mg(OH)2、Mg(OH)2.
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶或冷却结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCI3溶液吸收酸浸产生的气体,吸收时的氧化产物为S(填化学式):再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3.
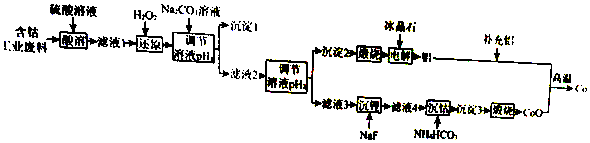
20.钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途.从某含钴工业废料中回收钴的工艺流程如图:
已知:
Ⅲ.离子浓度小于等于1.0×10-5mol•L-1时,认为该离子沉淀完全.
请回答下列问题:
(1)NaF的电子式为Na+[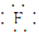 ]-.
]-.
(2)“沉淀1”的化学式为Fe(OH)3.“调节溶液pH2”的范围为4.7≤pH2<7.15.
(3)“还原”时发生反应的离子方程式为2CO3++H2O2=2CO2++O2↑2H+.“沉钴”时发生反应的离子方程式为CO2++2HCO3-=COCO3↓+CO2↑+H2O.
(4)制备Co时,“补充铝”的原因为原混合物中Al和Co的物质的量之比小于2:3.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=1.3×10-33.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为2SOCl2+4e-=S+SO2+4Cl-.

已知:
| 含钴废料的成分 | |||||
| 成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
| 质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
| Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
| 金属离子 | Fe3+ | Co2+ | Al3+ |
| 开始沉淀的pH | 1.9 | 7.15 | 3.4 |
| 沉淀完全的pH | 3.2 | 9.15 | 4.7 |
请回答下列问题:
(1)NaF的电子式为Na+[
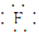 ]-.
]-.(2)“沉淀1”的化学式为Fe(OH)3.“调节溶液pH2”的范围为4.7≤pH2<7.15.
(3)“还原”时发生反应的离子方程式为2CO3++H2O2=2CO2++O2↑2H+.“沉钴”时发生反应的离子方程式为CO2++2HCO3-=COCO3↓+CO2↑+H2O.
(4)制备Co时,“补充铝”的原因为原混合物中Al和Co的物质的量之比小于2:3.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=1.3×10-33.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为2SOCl2+4e-=S+SO2+4Cl-.
10.短周期主族元索R、X、Y、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍,原子序数R+X=Y.下列说法不正确的是( )
| A. | 简单的离子半径:M>X>Y | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | X、M的最高氧化物对应的水化物均为强酸 | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
17.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 冷浓硝酸不能用铝制容器盛装 | |
| B. | 钠可从钴盐溶液中置换出钴单质 | |
| C. | 食盐中加入碘单质可以预防甲状腺肿大 | |
| D. | 光导纤维遇氢氧化钠溶液易“断路” |
14.下列化学工业所采取的措施中,能用勒夏特列原理解释的是( )
| A. | 合成氨工业:温度控制在500℃左右 | |
| B. | 接触法制硫酸:SO2在常压下催化氧化 | |
| C. | 侯氏制碱法:往母液中继续加入食盐和氨气 | |
| D. | 石油化工:将分馏得到的重油在高温下裂化 |
14.(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
(2)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→②→①→③.
(3)A瓶溶液的作用是验证产物中是否有二氧化硫,B瓶溶液的作用是除去二氧化硫,装置②中所加固体药品是(化学式)CuSO4.
(4)装置③中所盛溶液是澄清石灰水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.证明有二氧化碳生成的实验现象是C瓶中品红溶液不褪色,③中澄清石灰水变为浑浊
(5)装置B中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
| 编号 | ① | ② | ③ | ④ |
| 装置 | 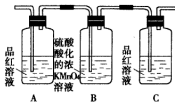 | 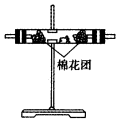 | 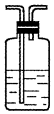 | 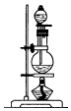 |
(3)A瓶溶液的作用是验证产物中是否有二氧化硫,B瓶溶液的作用是除去二氧化硫,装置②中所加固体药品是(化学式)CuSO4.
(4)装置③中所盛溶液是澄清石灰水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.证明有二氧化碳生成的实验现象是C瓶中品红溶液不褪色,③中澄清石灰水变为浑浊
(5)装置B中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.