题目内容
由0.2g氢气,2.8g氮气,0.4g氦气(He),3.2g氧气组成的混合气体在0℃,1.01×105Pa下所占的体积为( )
| A、7.84L |
| B、8.96L |
| C、15.68L |
| D、17.92L |
考点:气体摩尔体积
专题:
分析:根据n=
计算各物质的物质的量,再根据V=nVm计算混合气体的体积.
| m |
| M |
解答:
解:0.2g氢气的物质的量=0.2g÷2g/mol=0.1mol,
0.4g氦气的物质的量=0.4g÷4g/mol=0.1mol,
2.8g氮气的物质的量=2.8g÷28g/mol=0.1mol,
3.2氧气的物质的量=3.2g÷32g/mol=0.1mol,
故标况下混合气体的总体积=(0.1mol+0.1mol+0.1mol+0.1mol)×22.4L/mol=8.96L,
故选B.
0.4g氦气的物质的量=0.4g÷4g/mol=0.1mol,
2.8g氮气的物质的量=2.8g÷28g/mol=0.1mol,
3.2氧气的物质的量=3.2g÷32g/mol=0.1mol,
故标况下混合气体的总体积=(0.1mol+0.1mol+0.1mol+0.1mol)×22.4L/mol=8.96L,
故选B.
点评:本题考查我知道的有关计算,比较基础,注意对公式的理解掌握,注意气体摩尔体积的使用条件与对象.

练习册系列答案
相关题目
室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A、溶液中导电粒子的数目增加,导电性增强 | ||
| B、醋酸的电离程度增大,c(H+)亦增大 | ||
| C、再加入10mLpH=11NaOH溶液,混合液pH=7 | ||
D、溶液中
|
北京时间2月25日凌晨,服役了27年的“发现”号航天飞机从美国肯尼迪航天中心发射升空,开始了为期11天的“谢幕之旅”.并于北京时间27日3时14分,成功绝唱对接国际空间站.发现号航天飞机上有各式各样电池电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A、太阳能电池的主要材料为二氧化硅 |
| B、锌锰干电池工作原理与太阳能电池工作原理相同 |
| C、氢氧燃料电池工作时氢气在负极被还原 |
| D、锂离子电池优点是提供相同的电量所需的金属质量小 |
下列由极性键构成的非极性分子是( )
| A、N2 |
| B、HF |
| C、NH3 |
| D、CO2 |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,14 g N2含有的分子数为0.5NA |
| B、0.1mol/L的NaOH溶液中含钠离子数为0.1NA |
| C、6.72L NO2与足量H2O反应,转移的电子数为0.1NA |
| D、0.30mol Fe粉与足量水蒸气反应生成H2的物质的量为0.4NA |
下列离子方程式正确的是( )
A、甘氨酸(α-氨基乙酸)与氢氧化钠溶液反应: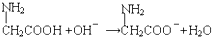 | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|

 且能发生银镜反应的X的同分异构体有
且能发生银镜反应的X的同分异构体有 某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O(未配平)实验主要步骤如下:
某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O(未配平)实验主要步骤如下: