题目内容
锌锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn (s)+2MnO2(s)+H2O (1)═Zn(OH)2(s)+Mn2O3 (s) 下列说法错误的是( )
| A、电池正极的电极反应式为:2 MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池工作时,电子由正极通过外电路流向负极 |
| D、电池工作时,锌极发生氧化反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该原电池中,负极反应式为Zn-2e-+2OH-=Zn(OH)2、正极反应式为2MnO2+2e-+H2O=Mn2O3+2OH-,放电时,电子从负极沿导线流向正极,据此分析解答.
解答:
解:A.根据电池反应式知,正极的电极反应式为:2 MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故A正确;
B.负极反应式为Zn-2e-+2OH-=Zn(OH)2,外电路中每通过0.2mol电子,锌的质量理论上减小质量=
×65g/mol=6.5g,故B正确;
C.放电时,电子从负极锌沿导线流向正极二氧化锰,故C错误;
D.放电时,负极上锌失电子发生氧化反应,故D正确;
故选C.
B.负极反应式为Zn-2e-+2OH-=Zn(OH)2,外电路中每通过0.2mol电子,锌的质量理论上减小质量=
| 0.2mol |
| 2 |
C.放电时,电子从负极锌沿导线流向正极二氧化锰,故C错误;
D.放电时,负极上锌失电子发生氧化反应,故D正确;
故选C.
点评:本题考查原电池原理,知道正负极的判断方法、电子流向等知识点即可解答,难点是电极反应式的书写.

练习册系列答案
相关题目
化学与环境、生产、生活密切相关,下列说法不正确的是( )
| A、成都加快建设地铁、轻轨,减少汽车尾气排放,符合“低碳经济”要求 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,有利于水果保鲜 |
| D、明矾水溶液中的氢氧化铝胶体能吸附水中悬浮物,达到净水目的 |
下列关于有机物的说法正确的是( )
| A、乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底 |
| B、乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法将三者分离 |
| C、煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化 |
| D、苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:SnCl2+Cl-+H3AsO3+H+--As+SnCl62-+M(未配平),关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成0.1mol的As,还原剂失去的电子为0.3mol ④M为OH-⑤SnCl62-是氧化产物 ⑥H+前面的配平系数为6.
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成0.1mol的As,还原剂失去的电子为0.3mol ④M为OH-⑤SnCl62-是氧化产物 ⑥H+前面的配平系数为6.
| A、①③⑤⑥ | B、①②④⑤ |
| C、①②③④ | D、只有①③⑥ |
恒温下,将1mol N2和3mol H2在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s时测得NH3的体积分数为25%.则下列说法中不正确的是( )
| A、用N2浓度的减少表示的平均反应速率为0.2 mol?L-1?s-1 |
| B、2 s时N2的转化率为40% |
| C、2 s时混合气体中n(N2)?n(H2)?n(NH3)=3:9:4 |
| D、2 s 时NH3的浓度为0.4 mol?L-1 |
下列事实能用勒夏特列原理解释的是( )
| A、H2、I2、HI 平衡混合气体加压后颜色变 |
| B、配制FeSO4溶液时在溶液中加入稀硫酸 |
| C、合成氨工业采用高温条件 |
| D、工业制硫酸中,SO2氧化成SO3,往往需使用催化剂 |
某有机化合物的结构简式如图:
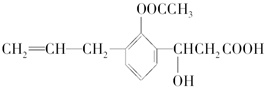
此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香化合物.

此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香化合物.
| A、①②③④⑥ | B、②④⑥ |
| C、②④⑤⑥ | D、①③⑤ |
25℃时,几种弱酸的电离常数如下:
25℃时,下列说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.6×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a和b的大小关系不确定 |
| C、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
| D、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) |
下列说法正确的是( )
| A、向0.01 mol?L-1醋酸溶液中加水,溶液中水电离产生的c(H+) 将减小 | ||
| B、将水加热,KW增大,pH不变,仍呈中性 | ||
| C、向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变 | ||
D、c(H+)=
|