题目内容
6.下列说法正确的是( )| A. | 标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2NA | |
| B. | 在标准状况下,1 mol H2O的体积可能是22.4 L | |
| C. | 当温度高于0℃时,一定量任何气体的体积都大于22.4 L | |
| D. | 标况下,某气体的体积为22.4 L,则该气体的物质的量为1 mol,所含的分子数目约为:6.02×1023 |
分析 A.根据n=$\frac{m}{M}$计算出混合气体的物质的量,最高价N=nNA计算出混合气体中含有的分子数;
B.标准状况下水的状态不是气态;
C.压强也影响气体体积,且没有告诉气体的物质的量,无法判断气体体积;
D.根据n=$\frac{V}{{V}_{m}}$计算出气体的物质的量,再根据N=nNA计算出所含分子数.
解答 解:A.标准状况下,22.4 L H2和Cl2的混合气体的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,1mol混合气体中含有的分子数为NA,故A错误;
B.由于标准状况下是不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.没有告诉气体的物质的量和压强,无法判断气体的体积,故C错误;
D.标况下某气体的体积为22.4 L,该气体的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,所含气体分子数目约为:N=nNA=6.02×1023mol-1×1mol=6.02×1023,故D正确;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与阿伏伽德罗常数、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
18.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | 标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2 NA | |
| D. | 将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
15.鉴别下列物质,只能用焰色反应的是( )
| A. | K2CO3和KCl | B. | NaCl和Na2CO3 | C. | NaCl和MgCl2 | D. | NaCl和KCl |
16.下列说法正确的是(设阿伏加德罗常数的数值为NA)( )
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
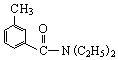 ; DEET在一定条件下,可通过下面的路线来合成:
; DEET在一定条件下,可通过下面的路线来合成: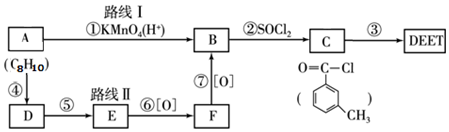
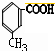 .
.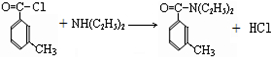 .
.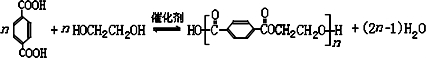 .
.