题目内容
8.共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式.下列物质的微粒间含有两种上述相互作用的是( )| A. | 干冰 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 金刚石 |
分析 一般金属元素与非金属元素之间形成离子键,非金属元素之间形成共价键,分子之间存在分子间作用力,以此来解答.
解答 解:A、干冰属于分子晶体,分子间通过分子间作用力结合,分子内存在共价键,故A正确;
B、氯化钠属于离子晶体,微粒间以离子键结合,故B错误;
C、氢氧化钠中存在离子键和共价键,故C正确;
D、金刚石是原子晶体,存在化学键,故D错误.
故选AC.
点评 本题考查化学键,为高频考点,熟悉常见物质中的化学键及化学键的形成规律即可解答,注意分子晶体中存在分子间作用力不属于化学键,题目难度不大.

练习册系列答案
相关题目
18.给盛有氯化钡稀溶液的甲、乙两支试管中分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
| A. | 甲、乙两试管都有白色沉淀生成 | |
| B. | 甲、乙两试管都没有白色沉淀生成 | |
| C. | 甲试管没有白色沉淀生成而乙试管有 | |
| D. | 甲试管有白色沉淀生成而乙试管没有 |
19.用价层电子对互斥理论预测PH3和CH2O分子的立体结构,两个结论都正确的是( )
| A. | 平面三角形;平面三角形 | B. | 平面三角形;三角锥形 | ||
| C. | 三角锥形;平面三角形 | D. | 三角锥形;三角锥形 |
3.下列说法错误的是( )
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 升高温度可使吸热反应的反应速率增大.使放热反应的反应速率减小 | |
| C. | 等量的甲烷在纯氧气中燃烧的火焰的温度比在空气中燃烧时高 | |
| D. | 用物质的量浓度相同的盐酸分别与相同质量的石灰石块和石灰石粉末反应,石灰石快反应速率慢 |
5.常温时,Ksp[Mg(OH)2]=1.1×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,Ksp(CH3COOAg)=2.3×10-3,下列叙述不正确的是( )
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
12.在同温、同压下,有同质量的气体X和Y,已知此时Y的体积大于X的体积,则它们的摩尔质量之间的关系是( )
| A. | M(X)>M(Y) | B. | M(X)<M(Y) | C. | M(X)=M(Y) | D. | 无法确定 |
10.下列推断正确的是( )
| A. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |

 ;
; .
. .
.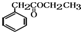 )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下: