题目内容
4.下列说法中,正确的是( )| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 在标准状况下,20 mL NH3 与60 mL O2所含的分子数比为1:3 | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
分析 A.单位不对,摩尔质量的单位是g/mol;
B.标准状况下水不是气体,不能带入V=n×Vm计算;
C.依据阿伏伽德罗定律,同温同压气体体积之比等于分子数之比;
D.缺少溶液的体积,不能计算.
解答 解:A.单位不对,SO2的摩尔质量是64 g/mol,故A错误;
B.18 g水的物质的量为$\frac{18g}{18g/mol}$=1mol,但标准状况下水不是气体,不能带入V=n×Vm计算,故B错误;
C.同温同压气体体积之比等于分子数之比,因此在标准状况下,20 mL NH3 与60 mL O2所含的分子数比为1:3,故C正确;
D.由n=cV可知,缺少溶液的体积V,不能计算溶质的物质的量,也不能计算其中含有的离子数,故D错误;
故选C.
点评 本题考查了摩尔质量、气体摩尔体积、阿伏伽德罗定律,题目难度中等,注意D中不能想当然的认为溶液的体积是1L.

练习册系列答案
相关题目
14.某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取氯化铜,其实验流程如下所示:
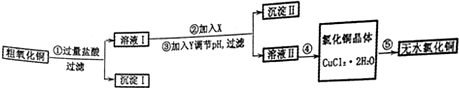
已知:
提供的试剂:A.NaOH B.H2O2 C.Na2CO3 D.CuO
(1)步骤②反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.步骤③中调节溶液pH的范围是3.2~4.7之间.
(2)如何判断沉淀Ⅱ已洗涤干净的方法是取最后一次洗涤液,加入硝酸酸化,再滴入硝酸银溶液,没有白色沉淀生成,说明洗涤干净,否则洗涤不干净.
(3)步骤④的方法是加热浓缩、冷却结晶、过滤、洗涤,
(4)步骤⑤要得到无水氯化铜,需要在赶在的HCl气流中加热CuCl2•2H2O其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
(5)若用电解法精炼铜,则阴极的电极反应式为Cu2++2e-=Cu.

已知:
| 金属离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
(1)步骤②反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.步骤③中调节溶液pH的范围是3.2~4.7之间.
(2)如何判断沉淀Ⅱ已洗涤干净的方法是取最后一次洗涤液,加入硝酸酸化,再滴入硝酸银溶液,没有白色沉淀生成,说明洗涤干净,否则洗涤不干净.
(3)步骤④的方法是加热浓缩、冷却结晶、过滤、洗涤,
(4)步骤⑤要得到无水氯化铜,需要在赶在的HCl气流中加热CuCl2•2H2O其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
(5)若用电解法精炼铜,则阴极的电极反应式为Cu2++2e-=Cu.
12.下列变化过程中只放出热量的是( )
| A. | 水结成冰 | B. | 干冰气化 | C. | 食盐溶于水 | D. | 浓硫酸稀释 |
19.在25℃,101kPa下,0.1molC2H2完全燃烧生成CO2和H2O(I)时放出129.96kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+129.96kJ | |
| B. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(g)-259.92kJ | |
| C. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)-1299.6kJ | |
| D. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2599.2kJ |
9.同浓度的下列水溶液中,溶液H+浓度最大的是( )
| A. | HCl | B. | H2CO3 | C. | H2SO4 | D. | CH3COOH |
16.一氧化碳还原氧化铁:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,在该反应中( )
| A. | 铁做还原剂 | B. | Fe2O3做氧化剂 | ||
| C. | 铁元素被还原 | D. | 铁元素化合价升高 |
13.下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
| A. | KOH Na2SO4 HCl | B. | NaHCO3 NaNO3 H2SO4 | ||
| C. | HCl Na2CO3 NaCl | D. | Ca(OH)2 Na2CO3 BaCl2 |
14.下列各变化中属于原电池反应的是( )
| A. | 锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 | |
| B. | 红热的铁丝与冷水接触,表面表成蓝黑色保护层 | |
| C. | 镀锌铁表面锌有划损时,仍然能阻止铁被氧化 | |
| D. | 在空气中金属铝表面迅速氧化形成保护层 |
