题目内容
1.NaH2PO2为正盐(填“正盐”或“酸式盐”),其溶液显碱性(填“弱酸性”“中性”或“弱碱性”).分析 H3PO2是一元中强酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性.
解答 解:H3PO2是一元中强酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性,水解方程式为H2PO2-+H2O?H3PO2+OH-;
故答案为:正盐;碱性.
点评 本题考查了弱电解质的电离、盐的水解原理,题目难度不大,明确盐的水解原理、电离方程式书写原则为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.将28g铁粉和8g硫粉混合隔绝空气加热,在反应后的物质中加足量盐酸,可生成标况下气体体积为( )
| A. | 11.2L | B. | 5.6L | C. | 8.4L | D. | 14L |
9.下列说法正确的是( )
| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目小于0.2NA | |
| B. | 100mL1.0mol/L的FeCl3溶液与足量Cu反应,转移电子数数为0.2NA | |
| C. | 标况下44.8mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA |
6.用下列实验装置进行相应实验,能达到实验目的是( )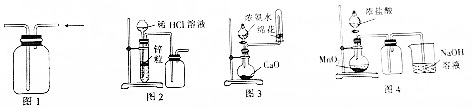

| A. | 用图1所示装置收集CO和NO | B. | 用图2所示装置制取少量氢气 | ||
| C. | 用图3所示装置制取少量氨气 | D. | 用图4所示装置制取少量氯气 |
7.普及化学知识有助于人们树立健康的观念.下列观念正确的是( )
| A. | 天然物质都是绿色无毒的物质 | B. | 只饮用纯净水有益人体健康 | ||
| C. | 禁止吸烟可减少室内空气污染 | D. | 微量元素只能通过保健品摄入 |
4.下列金属中,既能与酸反应又能与碱反应的是( )
| A. | 铁 | B. | 铜 | C. | 镁 | D. | 铝 |
5.国际相对原子质量表上查得的氢(H)是1.008,这是指( )
| A. | 同位素1H的相对原子质量 | |
| B. | 氢元素的平均相对原子质量 | |
| C. | 氢元素各同位素质量数与百分含量算出的平均值 | |
| D. | 同位素2H的相对原子质量 |
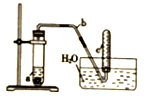 用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.
用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.