题目内容
15.硅在氧气中完全燃烧的化学方程式为:Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2,1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi-Si键、1molO=O键和1molSi-O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi-O键,则1molSi中含有Si-Si键的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
分析 1molSi完全燃烧生成SiO2放出992kJ的热量,则Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2 的△H=-992kJ/mol,结合△H=E(断裂化学键的键能之和)-E(形成化学键的键能之和),以此来解答.
解答 解:设1molSi中含有Si-Si键的物质的量为x,1molSi完全燃烧生成SiO2放出992kJ的热量,
断裂1molSi-Si键、1molO=O键和1molSi-O键吸收的能量分别为176kJ、496kJ、460kJ.1molSiO2中含有4molSi-O键,
△H=E(断裂化学键的键能之和)-E(形成化学键的键能之和),则
x×176+496kJ-4×460kJ=-992kJ,
解得x=2mol,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能之间的关系为解答的关键,侧重分析与计算能力的考查,注意晶体中化学键的数目,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列分子或离子中空间构型是V形的是( )
| A. | H3O+ | B. | H2O | C. | NO2+ | D. | NO2- |
6.关于中和热测定实验的下列说法不正确的是( )
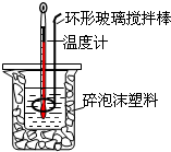

| A. | 使用环形玻璃棒既可以搅拌又避免损坏温度计 | |
| B. | 测了酸后的温度计要用水清洗后再测碱的温度 | |
| C. | 向盛装酸的烧杯中加碱时要小心缓慢以免洒出 | |
| D. | 改变酸碱的用量,所求中和热数值不变 |
10.下列有关描述正确的是( )
| A. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 | |
| B. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 | |
| C. | 雷电能固氮属于自然固氮,而工业合成氨及氨的催化氧化均属于人工固氮 | |
| D. | 乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |
20.联合国卫生组织经过考核和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广.其主要原因是( )
| A. | 价格便宜,不易生锈 | |
| B. | 铁锅含有碳元素 | |
| C. | 烹调的食物中留有人体需要的铁元素 | |
| D. | 传热慢,保温性能好 |
7.利用Y型管与其它仪器组合可以进行许多实验(固定装置略).分析并回答下列问题:
| 实验 | 装置 |
| (1)实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为管壁内有淡黄色固体生成;硫化亚铁处加水的目的是稀释浓硫酸,防止硫化氢被氧化. |  |
| (2)实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是抬高(或移动)水准管位置,使水准管、量气管内液面相平. ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为 69.14%(保留2位小数,气体体积已折算为标况). |  |
| (3)实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是浓氨水、碱石灰(必要时可以加热),该沉淀的化学式为BaSO3. |  |
4.下列元素中,非金属性最弱的是( )
| A. | F | B. | O | C. | S | D. | Cl |
5.铝和铝合金具有许多优良的性质,用途广泛.下列用途主要是体现铝的物理性质的是( )
①制导线②盛浓硫酸的容器③包装用的铝箔④工业上冶炼金属钒、铬、锰等⑤工业制做热交换器⑥做合金用作飞机制造业材料.
①制导线②盛浓硫酸的容器③包装用的铝箔④工业上冶炼金属钒、铬、锰等⑤工业制做热交换器⑥做合金用作飞机制造业材料.
| A. | ①③⑤⑥ | B. | ②③④⑥ | C. | ①②③④⑤ | D. | ①③④⑥ |
