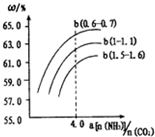
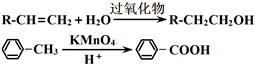
题目内容
5.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(假设金属的摩尔质量为M g•mol-1,金属原子半径为r cm,用NA表示阿伏加德罗常数的值)( )
| A. | 金属Mg采用②堆积方式 | |
| B. | ①和③中原子的配位数分别为:8、12 | |
| C. | 对于采用②堆积方式的金属,实验测得W g该金属的体积为V cm3,则阿伏加德罗常数NA的表达式为$\frac{MV}{W•(\frac{4}{\sqrt{3}}r)^{3}}$ | |
| D. | ④中空间利用率的表达式为:$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4}{\sqrt{2}}r)^{3}}$×100% |
分析 A.Mg属于六方最密堆积;
B. 配位数是6;
配位数是6; 配位数为12;
配位数为12;
C.根据均摊法计算;
D.面心立方堆积 空间利用率为$\frac{原子体积}{晶胞体积}$×100%.
空间利用率为$\frac{原子体积}{晶胞体积}$×100%.
解答 解:A.Mg属于六方最密堆积,所以金属Mg采用③堆积方式,故A错误;
B. ,其配位数是6,
,其配位数是6, ,配位数为12,故B错误;
,配位数为12,故B错误;
C. 中原子个数为8×$\frac{1}{8}$+1=2,晶胞质量m=2M,密度$ρ=\frac{W}{V}$=$\frac{\frac{2M}{{N}_{A}}}{(\frac{4r}{\sqrt{2}})^{3}}$,故C错误;
中原子个数为8×$\frac{1}{8}$+1=2,晶胞质量m=2M,密度$ρ=\frac{W}{V}$=$\frac{\frac{2M}{{N}_{A}}}{(\frac{4r}{\sqrt{2}})^{3}}$,故C错误;
D.面心立方堆积 空间利用率为$\frac{原子体积}{晶胞体积}$×100%=$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4r}{\sqrt{2}})^{3}}×100%$,故D正确.
空间利用率为$\frac{原子体积}{晶胞体积}$×100%=$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4r}{\sqrt{2}})^{3}}×100%$,故D正确.
故选:D.
点评 本题考查金属晶体堆积模型,为高频考点,侧重考查学生分析及空间想象能力,难点是配位数的判断及空间利用率计算,注意晶胞中哪些原子紧挨着,为易错点.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
13.现在电池的种类非常多,且由电池造成的污染越来越严重,下列电池不会造成环境污染的是( )
| A. | 碱性锌锰电池 | B. | 氢氧燃料电池 | C. | 酸性锌锰电池 | D. | 镍镉电池 |
20.反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,一分钟后,NO的物质的量增加了0.3mol,此反应的平均反应速率表达正确的是( )
| A. | v(O2)=0.001mol•L-1•s-1 | B. | v(NO)=0.0015 mol•L-1•s-1 | ||
| C. | v(H20)=0.003 mol•L-1•s-1 | D. | v(NH3)=0.001 mol•L-1•s-1 |
10.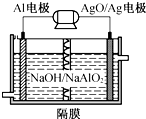 铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
 铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )| A. | OH-向Al电极移动 | |
| B. | 正极的电极反应式:O2+2H2O+4e-═4OH- | |
| C. | Al电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 当电极上析出0.54 g Ag时,电路中转移的电子为0.005 mol |
14.某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象.请帮助该同学整理并完成实验报告.
(1)实验目的:研究同周期金属元素性质递变规律.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
(3)写出实验①和④对应化学方程式
实验①Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
实验④2Al+6HCl=2AlCl3+3H2↑.
(4)实验结论:第三周期元素随着核电荷数的递增,金属性逐渐减弱.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
实验①Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
实验④2Al+6HCl=2AlCl3+3H2↑.
(4)实验结论:第三周期元素随着核电荷数的递增,金属性逐渐减弱.

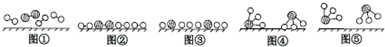
 、
、 、
、 分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂
分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂