题目内容
下列有关实验的说法不正确的是( )
| A、取用液溴时,应戴上橡皮手套 |
| B、配制一定物质的量浓度的NaCl溶液时,NaCl应在烧杯中溶解 |
| C、加热乙酸、乙醇、浓硫酸的混合物制备乙酸乙酯时,应加入2~3块碎瓷片 |
| D、无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- |
考点:药品的取用,溶液的配制,常见阴离子的检验,乙酸乙酯的制取
专题:化学实验基本操作
分析:A、从液溴有很强的腐蚀性来分析;
B、配制一定物质的量浓度的溶液时,固体的溶解场所是烧杯;
C、碎瓷片的作用是防止暴沸;
D、白色沉淀可能为AgCl,且硝酸酸化可能将亚硫酸根离子氧化为硫酸根离子.
B、配制一定物质的量浓度的溶液时,固体的溶解场所是烧杯;
C、碎瓷片的作用是防止暴沸;
D、白色沉淀可能为AgCl,且硝酸酸化可能将亚硫酸根离子氧化为硫酸根离子.
解答:
解:A、液溴有很强的腐蚀性,故取用的时候要带橡胶手套,故A正确;
B、配制一定物质的量浓度的溶液时,固体的溶解要在烧杯里进行,故B正确;
C、碎瓷片能能起到防止暴沸的作用,故C正确;
D、白色沉淀可能为AgCl,且硝酸酸化可能将亚硫酸根离子氧化为硫酸根离子,应先加盐酸,再加BaCl2溶液检验SO42-,故D错误.
故选D.
B、配制一定物质的量浓度的溶液时,固体的溶解要在烧杯里进行,故B正确;
C、碎瓷片能能起到防止暴沸的作用,故C正确;
D、白色沉淀可能为AgCl,且硝酸酸化可能将亚硫酸根离子氧化为硫酸根离子,应先加盐酸,再加BaCl2溶液检验SO42-,故D错误.
故选D.
点评:本题考查物质的检验和实验问题,为高频考点,把握离子的检验方法、试剂及现象与结论为解答的关键,侧重离子检验的考查,注意检验应排除干扰离子,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
下列化学反应的有机产物中,存在同分异构体的是( )
| A、(CH3)2CHCH2Br在碱性溶液中水解 |
| B、苯在催化剂FeCl3作用下与Cl2反应 |
C、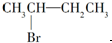 与NaOH的醇溶液共热反应 与NaOH的醇溶液共热反应 |
D、 在催化剂存在下与H2完全加成 在催化剂存在下与H2完全加成 |
液氨是富氢物质,是氢能的理想载体,利用N2+3H2
2NH3实现储氢和输氢.下列说法不正确的是 ( )
| 催化剂 |
| A、NH3分子中N原子采用sp2杂化 |
| B、相同压强时,NH3沸点比PH3高 |
| C、[Cu(NH3)4]2+离子中,N原子是配位原子 |
D、CN-的电子式为: |
关于醋酸的下列说法不正确的是( )
| A、既能与有机物反应又能与无机物反应 |
| B、既能发生复分解反应又能发生水解反应 |
| C、既能发生置换反应又能发生酯化反应 |
| D、既能发生取代反应又能发生氧化还原反应 |
某溶液加入铝能产生氢气.则下列各组离子,在该水溶液中可以大量共存的是( )
| A、Fe2+、K+、Cl-、NO3- |
| B、K+、Mg2+、Cl-、SO42- |
| C、Na+、Fe3+、CO32-、SO42- |
| D、NH4+、Ba2+、AlO2-、Cl- |
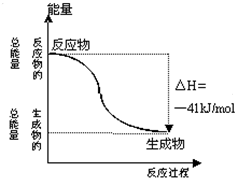 已知一定条件下,CO(g)+H2O (g)=CO2(g)+H2(g)反应过程能量变化如图所示,下列有关该反应的说法正确的是( )
已知一定条件下,CO(g)+H2O (g)=CO2(g)+H2(g)反应过程能量变化如图所示,下列有关该反应的说法正确的是( )| A、该反应为吸热反应 |
| B、CO(g)与H2O(g)所具有的总能量大于CO2(g)与H2(g)所具有的总能量 |
| C、反应的热化学方程式是:CO(g)+H2O (g)=CO2 (g)+H2 (g);△H=+41kJ/mol |
| D、1mol CO2 (g)和1mol H2 (g)反应生成1molCO(g) 和1mol H2O(g)要放出41kJ热量 |
下列混合物,能用分液漏斗进行分离的是( )
| A、水与酒精 | B、水与醋酸 |
| C、水与植物油 | D、水与蔗糖 |