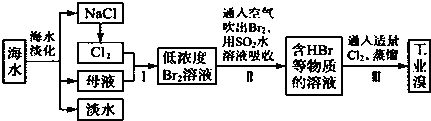
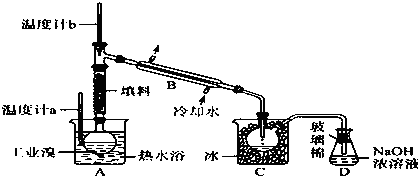
题目内容
15.常温下,下列叙述错误的是( )| A. | 向0.1 mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)═c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
分析 A.醋酸中存在电离平衡,加水促进醋酸的电离,加HCl抑制醋酸的电离;
B.0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后生成等物质的量浓度的醋酸和醋酸钠、NaCl;
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合,生成等浓度的(NH4)2SO4和Na2SO4,铵根离子水解浓度减小;
D.酸溶液中的氢氧根离子是水电离的,结合水的离子积计算出该溶液中氢离子浓度,然后可计算出水电离的氢离子浓度.
解答 解:A.醋酸中存在电离平衡,加水促进醋酸的电离,使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,加HCl抑制醋酸的电离,醋酸的物质的量增大,氢离子的物质的量也增大,但是氢离子增大的程度大,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,故A正确;
B.0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后生成等物质的量浓度的醋酸和醋酸钠、NaCl,由于醋酸小部分电离,所以c(CH3COOH)>c(H+),则c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B错误;
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合,生成等浓度的(NH4)2SO4和Na2SO4,铵根离子水解浓度减小,溶液显酸性,则:c (Na+)═c (SO42-)>c(NH4+)>c(H+)>c(OH-),故C正确;
D.根据$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8和c(H+)×c(OH-)=10-14可知,c(H+)=0.001mol/L,HA溶液中的氢氧根离子是水电离的,则由水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{0.001}$mol/L=10-11mol/L,故D正确.
故选B.
点评 本题考查电解质的电离和盐类的水解,属于综合知识的考查,题目难度中等,明确电离平衡及其影响因素为解答关键,注意掌握盐的水解原理及其影响,试题培养了学生的灵活应用能力.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | Fe3O4与足量稀 HNO3 反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| B. | 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O | |
| C. | 双氧水中加入稀硫酸和 KI 溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 往碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
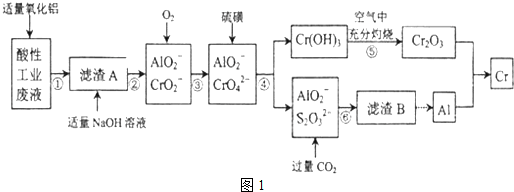
有关数据如表:
| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的PH | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH.
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在(5.3,7.8)范围(保留小数点后l位).
(3)步骤②中生成NaCrO2 的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(4)步骤④中反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-.
(5)步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,可选用的装置是图2中的D.(填序号)
(6)步骤⑦中发生的化学反应方程式为Cr2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$2Cr+Al2O3.
| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
(4)1mol单质Zn与 2mol Z元素形成的强酸浓溶液反应生成的气体是SO2,如何检验产生的气体产物用品红检验,如品红褪色,且加热溶液变红
(5)单质W与有机物CH3CH(OH)COOH反应的化学方程式为2Na+CH3CH(OH)COOH→CH3CH(ONa)COONa+H2↑,.
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 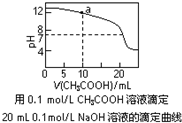 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
| A. | c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | B. | c(HAc)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.02mol/L |
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |