题目内容
9.复印机工作时,空气中的氧气可以转化为臭氧:3O2═2O3,下列有关说法正确的是( )| A. | 该变化属于物理变化 | B. | 1mol 臭氧比 1mol 氧气的能量高 | ||
| C. | 空气中臭氧比氧气更稳定 | D. | 氧分子中的化学键断裂会放出能量 |
分析 A、有新物质生成的变化为化学变化;
B、常温下,氧气很难转化为臭氧,而在复印机工作的高温条件下,氧气可以转化为臭氧;
C、臭氧易分解;
D、化学键的断裂要吸收能量.
解答 解:A、有新物质生成的变化为化学变化,此反应有新物质生成,故为化学变化,故A错误;
B、常温下,氧气很难转化为臭氧,而在复印机工作的高温条件下,氧气可以转化为臭氧,故此反应为吸热反应,即1mol臭氧的能量高于1mol氧气的能量,故B正确;
C、臭氧易分解为氧气,即氧气比臭氧稳定,故C错误;
D、化学键的断裂要吸收能量,故氧气分子中的化学键断裂要吸收能量,故D错误.
故选B.
点评 本题考查了化学变化和物理变化的区别以及物质能量高低的判断能,难度不大,应注意的是臭氧在空气中易转化为氧气.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
19.下列化学用语正确的是( )
| A. | 氯化钠的电子式  | B. | 乙炔的结构式 H-C=C-H | ||
| C. | 磷原子的结构示意图  | D. | 氨的分子式 NH3 |
20.化学与生活密切相关,下列说法正确的是( )
| A. | SO2可用于杀菌、消毒 | |
| B. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 | |
| C. | 碘是人体必需微量元素,所以要多吃富含髙磷酸的食物 | |
| D. | 海水淡化的方法主要有蒸馏法、电解法、离子交换法等 |
17.制出了第一张元素周期表的科学家是( )
| A. | 勒夏特列 | B. | 汤姆生 | C. | 阿伏伽德罗 | D. | 门捷列夫 |
4.下列互为同位素的是( )
| A. | Na 和 Na+ | B. | H2和 D2 | C. | 16O 和 18O | D. | CO 和 CO2 |
14.下列叙述正确的是( )
| A. | 甲酸溶液导电性比乙酸溶液导电性强,说明乙酸是弱酸 | |
| B. | 硫酸钾溶于水能导电,所以硫酸钾是电解质 | |
| C. | 强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 | |
| D. | 固态磷酸是电解质,所以磷酸在熔融状态下和水溶液中都能导电 |
1.下列物质的分类合理的是( )
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、纯碱 | |
| C. | 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O2、CaO、MgO、Al2O3 |
18.下列物质一定属于同系物的是( )
①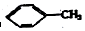 ②
②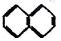 ③
③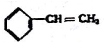 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦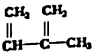 ⑧
⑧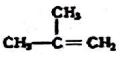
①
 ②
② ③
③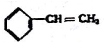 ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C2H6 ⑦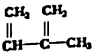 ⑧
⑧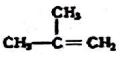
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ⑥和⑧ |
4.写出下列反应的热化学方程式:
(1)3mol NO2(g)与1mol H2O(l)反应生成HNO3(aq)和NO(g),放热138kJ.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(2)用CO还原1mol Fe2O3,放热24.8kJ.3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H=-24.8kJ/mol;
(3)1mol HgO(s)分解为液态汞和氧气,吸热90.7kJ.HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol;
(4)卫星发射时可用肼(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol;
(5)6.4g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-1135kJ/mol;
(6)已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据下表中所列键能数据估算a的数值为-93;
(7)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g )+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(1)3mol NO2(g)与1mol H2O(l)反应生成HNO3(aq)和NO(g),放热138kJ.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(2)用CO还原1mol Fe2O3,放热24.8kJ.3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H=-24.8kJ/mol;
(3)1mol HgO(s)分解为液态汞和氧气,吸热90.7kJ.HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol;
(4)卫星发射时可用肼(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol;
(5)6.4g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-1135kJ/mol;
(6)已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据下表中所列键能数据估算a的数值为-93;
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g )+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变△H=+226.7kJ•mol-1.