题目内容
7.铁元素不仅可以与SCN-、CN-等离子形成配合物,还可以与CO、NO等分子以及许多有机试剂形成配合物.回答下列问题:(1)基态铁原子有4个未成对电子;
(2)CN-有毒,含CN-的工业废水必须处理,用TiO2作光催化剂可将废水中的CN-转化为OCN-,并最终氧化为N2、CO2
①C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
②1molFe(CN)32-中含有e键的数目为6NA;
③铁与CO形成的配合物Fe(CO)3的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)3晶体属于分子晶体(填晶体类型)
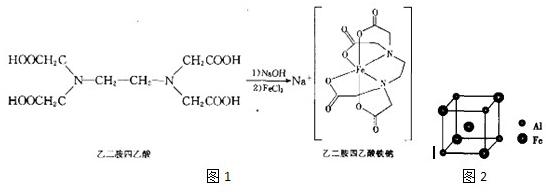
(3)乙二胺四乙酸能和Fe2+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如图1:
①乙二胺四乙酸中碳原子的杂化轨道类型是分子晶体;
②乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
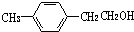
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成,小立方体如图2所示,则该合金的化学式为AlFe3,已知小立方体边长为acm,此铁铝合金的密度为$\frac{195}{{a}^{3}{N}_{A}}$k•cm-3.
分析 (1)依据基态铁原子的核外电子排布判断未成对电子;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素;
②1molFe(CN)32-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个CN-与铁离子形成3个配位键,所以共用6个σ键,1molFe(CN)32-中含有σ键数为6mol;
③依据Fe(CO)3的熔沸点低,且易溶于四氯化碳判断晶体类型;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
②氢键的存在能够显著提高物质的熔沸点;
(4)依据铁铝合金晶胞结构铝原子的数目为4×$\frac{1}{8}$=$\frac{1}{2}$;铁原子数目为1+4×$\frac{1}{8}$=$\frac{3}{2}$,所以铝原子与铁原子个数之比为1:3;
计算一个晶胞的质量m,计算晶胞的体积V,依据ρ=$\frac{m}{V}$计算其密度.
解答 解:(1)基态铁原子的核外电子排布为:1s22s22p63s23p63d64s2,3d6中,最多容纳10个电子,现在有6个,先占据单个的,所以只有2个成对,还有4个未成对,
故答案为:4;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
故答案为:N>O>C;
②1molFe(CN)32-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个CN-与铁离子形成1个配位键,所以共有3个σ键,1molFe(CN)32-中含有σ键数为6mol,个数为:6NA;
故答案为:6NA;
③Fe(CO)3的熔沸点低,且易溶于四氯化碳,依据分子晶体熔沸点低,且存在相似相溶原理,可知Fe(CO)3为分子晶体;
故答案为:分子晶体;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
故答案为:sp2、sp3;
②乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以乙二胺(H2NCH3CH2NH3)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多;
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)依据铁铝合金晶胞结构铝原子的数目为4×$\frac{1}{8}$=$\frac{1}{2}$;铁原子数目为1+4×$\frac{1}{8}$=$\frac{3}{2}$,所以铝原子与铁原子个数之比为1:3,该铁铝合金的化学式为:AlFe3;一个小立方体质量为$\frac{27}{2×6.02×10{\;}^{23}}$g+$\frac{56×3}{2×6.02×1023}$g=$\frac{195}{2×{N}_{A}}$g,所以其密度ρ=$\frac{m}{V}$=$\frac{195}{{a}^{3}{N}_{A}}$g•cm-3;
故答案为:AlFe3;$\frac{195}{{a}^{3}{N}_{A}}$.
点评 本题为结构体,考查了电子的排布、电离能大小的判断、杂化方式的判断、晶胞的相关技术,题目综合性强,难度大,明确晶胞结构是解题关键.

| A. | 1:1 | B. | 2:1 | C. | 4:1 | D. | 无法确定 |
| A. | 天然气的燃烧 | B. | 乙烯使溴水褪色 | ||
| C. | 苯与浓硝酸反应 | D. | 溴乙烷与氢氧化钠的醇溶液反应 |
| A. | 1:4 | B. | 1:2 | C. | 1:1 | D. | 2:1 |
| A. | 原子半径 Cl>Si>Na | B. | 金属性 Na>Mg>Al | ||
| C. | 碱性 LiOH>NaOH>KOH | D. | 酸性 H3PO4>H2SO4>HClO4 |
| A. | SO3+H2O═H2SO4 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.
 ,F的分子式C9H10.
,F的分子式C9H10. .
. ;
; .
. 在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.
在催化剂作用下,与H2加成后的产物名称为2,3-二甲基丁烷.