题目内容
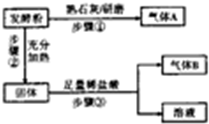 发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验:
发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验:【提出假设】
(1)假设1:由小苏打和碳酸氢铵组成;
假设2:由小苏打和明矾组成;
假设3:由
【方案与流程】
为探究某品牌发酵粉的化学成分,某同学设计如下实验,得到如图现象
(2)气体A的化学式为
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液.观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:
(4)另一品牌发酵粉的化学组成可能为假设2情况,请你设计实验验证,写出实验步骤、预期现象和结论.
| 实验步骤 | 预期现象 |
| 1.取适量样品溶于稀盐酸后,将溶液分成两份 | |
| 2. | |
| 3. | |
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)三种物质分由两种物质组合,题中有2种了,剩下的就是由碳酸氢钠和明矾组成;
(2)与碱反应生成的气体是氨气,且该物质必含铵根离子,故含有臭粉(碳酸氢铵),加热分解后的物质和盐酸反应生成气体,应含有小苏打(碳酸氢钠);
(3)碳酸钠和硫酸铝钾均能与氯化钡反应反应产生白色沉淀;
(4)利用焰色反应检验溶液中钠离子,确定含有碳酸氢钠;铝离子的物质与碱反应生成沉淀后沉淀溶解,据此检验铝离子,确定含有硫酸铝钾;
(5)依据元素守恒列式计算,生成的沉淀为碳酸钙;
(2)与碱反应生成的气体是氨气,且该物质必含铵根离子,故含有臭粉(碳酸氢铵),加热分解后的物质和盐酸反应生成气体,应含有小苏打(碳酸氢钠);
(3)碳酸钠和硫酸铝钾均能与氯化钡反应反应产生白色沉淀;
(4)利用焰色反应检验溶液中钠离子,确定含有碳酸氢钠;铝离子的物质与碱反应生成沉淀后沉淀溶解,据此检验铝离子,确定含有硫酸铝钾;
(5)依据元素守恒列式计算,生成的沉淀为碳酸钙;
解答:
解:(1)三种物质分由两种物质组合,题中有2种了,剩下的就是由碳酸氢钠和明矾组成,
故答案为:碳酸氢钠和明矾;
(2)与碱反应生成的气体A是氨气,且该物质必含铵根离子,故含有臭粉(碳酸氢铵),加热分解后的物质和盐酸反应生成气体,应含有小苏打(碳酸氢钠),综上所述,该发酵粉的成分为NaHCO3和NH4HCO3;
故答案为:NH3;NaHCO3和NH4HCO3;
(3)碳酸钠和硫酸铝钾均能与氯化钡溶液反应反应产生白色沉淀,不能步骤③中足量稀盐酸改为足量氯化钡溶液,
故答案为:不能;碳酸钠和硫酸铝钾均能与氯化钡溶液反应反应产生白色沉淀;
(4)步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色;焰色呈黄色证明有Na+,发酵粉中有NaHCO3;
步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液;看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾;
故答案为:
(5)设NaHCO3的物质的量为x,NH4HCO3物质的量为y,依据生成的白色沉淀为碳酸钙,由碳元素守恒可得:
x+y=0.05mol,84x+79y=4.05g
x=0.02mol,y=0.03mol,则该发酵粉的化学式为:2NaHCO3?3NH4HCO3;
故答案为:2NaHCO3?3NH4HCO3.
故答案为:碳酸氢钠和明矾;
(2)与碱反应生成的气体A是氨气,且该物质必含铵根离子,故含有臭粉(碳酸氢铵),加热分解后的物质和盐酸反应生成气体,应含有小苏打(碳酸氢钠),综上所述,该发酵粉的成分为NaHCO3和NH4HCO3;
故答案为:NH3;NaHCO3和NH4HCO3;
(3)碳酸钠和硫酸铝钾均能与氯化钡溶液反应反应产生白色沉淀,不能步骤③中足量稀盐酸改为足量氯化钡溶液,
故答案为:不能;碳酸钠和硫酸铝钾均能与氯化钡溶液反应反应产生白色沉淀;
(4)步骤2:用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色;焰色呈黄色证明有Na+,发酵粉中有NaHCO3;
步骤3:向B试管中逐滴滴加0.1mol/L NaOH溶液;看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾;
故答案为:
| 实验步骤 | 预期现象 |
| 用洁净的铂丝蘸取A中的溶液,在酒精灯火焰上灼烧,观察焰色 | 焰色呈黄色证明有Na+,发酵粉中有NaHCO3 看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾 |
| 向B试管中逐滴滴加0.1mol/L NaOH溶液 | |
x+y=0.05mol,84x+79y=4.05g
x=0.02mol,y=0.03mol,则该发酵粉的化学式为:2NaHCO3?3NH4HCO3;
故答案为:2NaHCO3?3NH4HCO3.
点评:本题考查实验探究物质的组成成分、猜想与事实验证、Na+检验方法、钠铝重要化合物及铵盐的性质等,本题考查的为实验探究题,解这类题的关键,就是抓住题给的信息,认真分析来完成题目,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48gO3含有的氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为1.1NA |
| C、常温常压下,11.2L氧气所含的原子数为NA |
| D、2.4g金属镁变为镁离子时失去的电子数为0.1NA |
下列各组物质中,不属于同素异形体的是( )
| A、石墨和金刚石 |
| B、H2O和H2O2 |
| C、O3与O2 |
| D、S2和S8(两种不同硫单质分子) |
在一种一元碱ROH的溶液中,加入一种一元酸HA溶液,当反应后溶液呈现中性,下列判断中一定正确的是( )
| A、加入的一元酸HA过量 |
| B、生成的盐RA不能发生水解 |
| C、加入的酸与碱的物质的量相等 |
| D、反应后溶液中C(A-)=C(R+) |
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )


| A、X、Y、Z三种元素中,X的非金属性最强 |
| B、Y的氢化物的稳定性比Z的强 |
| C、Y的最高正化合价为+7价 |
| D、X的单质的熔点比Z的高 |
X、Y、Z为三种短周期元素,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子与Y原子的最外层电子数之差为3.下列叙述正确的是( )
| A、X、Y、Z三种元素不能组成一种盐 |
| B、X单质与Z单质直接反应可生成两种化合物 |
| C、X、Y、Z的最高价氧化物对应的水化物,可能是酸、碱或两性的物质 |
| D、X、Y形成的一种离子跟H+反应可生成Y的离子 |
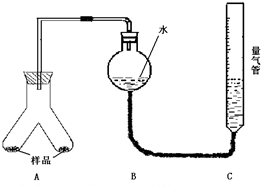 为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题: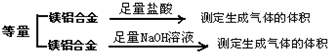
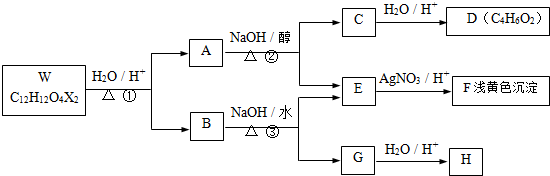
 ,反应④的化学方程式是
,反应④的化学方程式是