题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48gO3含有的氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为1.1NA |
| C、常温常压下,11.2L氧气所含的原子数为NA |
| D、2.4g金属镁变为镁离子时失去的电子数为0.1NA |
考点:阿伏加德罗常数
专题:
分析:A、依据n=
计算物质的量,结合分子式计算原子数;
B、依据n=
计算物质的量,结合铵根离子结构计算电子数;
C、标准状况气体摩尔体积为22.4L/mol;
D、依据n=
计算物质的量,结合镁失去2个电子形成镁离子计算.
| m |
| M |
B、依据n=
| m |
| M |
C、标准状况气体摩尔体积为22.4L/mol;
D、依据n=
| m |
| M |
解答:
解:A、依据n=
计算物质的量=
=1mol,结合分子式计算原子数为3NA,故A正确;
B、依据n=
计算物质的量=
=0.1mol,结合铵根离子结构计算电子数为NA,故B错误;
C、标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量不是0.5mol,故C错误;
D、依据n=
计算物质的量
=0.1mol,结合镁失去2个电子形成镁离子计算失去的电子数为0.2NA,故D错误;
故选A.
| m |
| M |
| 48g |
| 48g/mol |
B、依据n=
| m |
| M |
| 1.8g |
| 18g/mol |
C、标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量不是0.5mol,故C错误;
D、依据n=
| m |
| M |
| 2.4g |
| 24g/mol |
故选A.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,物质的量和微粒数的计算关系分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
 在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )
在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )| A、p3>p4,Y轴表示A的转化率 |
| B、p3>p4,Y轴表示B的质量分数 |
| C、p3>p4,Y轴表示混合气体的密度 |
| D、p3>p4,Y轴表示混合气体的平均相对分子质量 |
密闭容器内发生氨分解反应:2NH3?N2+3H2.已知NH3起始浓度是2.6mol?L-1,4s末为1.0mol?L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为( )
| A、0.04 mol?L-1?s-1 |
| B、0.4 mol?L-1?s-1 |
| C、1.6 mol?L-1?s-1 |
| D、0.8 mol?L-1?s-1 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| B、常温常压下,16 g氧气和臭氧(O3)的混合气体中含有NA 个氧原子 |
| C、12g NaHSO4在熔融时离子总数为0.3NA个 |
| D、标准状况下,11.2L氦气所含的原子数为NA个 |
下列说法正确是( )
| A、摩尔是物质的质量单位 |
| B、氧气的摩尔质量是32g |
| C、0.5mol氮气的体积为11.2L |
| D、1mol硫酸根的质量为96g |
将30mL 0.5mol/L的NaOH溶液加水稀释到500mL,稀释后NaOH的物质的量浓度为( )
| A、0.3mol/L |
| B、0.05mol/L |
| C、0.04mol/L |
| D、0.03mol/L |
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构简式为: ,它属于( )
,它属于( )
 ,它属于( )
,它属于( )| A、烃类 | B、无机物 |
| C、有机物 | D、烷烃 |
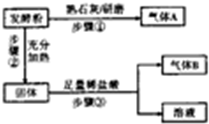 发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验:
发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验: