题目内容
下列各电子式书写正确的是( )
A、氯化钠 |
B、氮气 |
C、氯化氢 |
D、二氧化碳 |
考点:电子式
专题:化学键与晶体结构
分析:分析所给微粒类型,根据化学键类型及原子间形成共用电子对数目解答.
解答:
解:A、氯化钠为离子化合物,氯离子带电荷并需用方括号括起来,钠离子用离子符号表示,故A错误;
B、氮原子最外层有5个电子,要达到稳定结构得形成三对共用电子对,即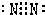 ,故B错误;
,故B错误;
C、氯化氢为共价化合物,分子中没有离子,电子式为 ,故C正确;
,故C正确;
D、二氧化碳为共价化合物,分子中存在两个碳氧双键,碳原子最外层达到8个电子稳定结构,电子式为: ,故D错误;
,故D错误;
故选C.
B、氮原子最外层有5个电子,要达到稳定结构得形成三对共用电子对,即
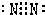 ,故B错误;
,故B错误;C、氯化氢为共价化合物,分子中没有离子,电子式为
 ,故C正确;
,故C正确;D、二氧化碳为共价化合物,分子中存在两个碳氧双键,碳原子最外层达到8个电子稳定结构,电子式为:
 ,故D错误;
,故D错误;故选C.
点评:本题考查电子式的正误判断,题目难度中等,该题是基础性试题的考查,主要是考查学生对常见物质电子式的熟悉了解程度,旨在巩固学生的基础,提高学生的应试能力和规范答题能力,明确物质中化学键的类型是答题的关键.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
下列化学用语正确的是( )
A、丙烷分子的比例模型为: |
B、硝基苯的结构简式  |
C、光气COCl2的结构式: |
D、一CH3(甲基)的电子式为: |
在标准状况下,22.4L CH4与氯气在光照下发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的氯气为( )
| A、0.5 mol |
| B、2 mol |
| C、2.5 mol |
| D、4 mol |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与NaOH溶液反应.下列说法不正确的是( )
| A、原子半径:Y>Z>W |
| B、非金属性最强的元素为W |
| C、Z的最高价氧化物对应的水化物为强酸 |
| D、XW2分子中各原子最外层电子均达到8电子结构 |
下列各分子中,化学键类型有差异的是( )
| A、H2O、CO2 |
| B、MgF2、H2O2 |
| C、NaOH、Ba(OH)2 |
| D、NaCl、KCl |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成氯化钠(X)、次氯酸钠(Y)和氯酸钠(Z)共存体系,下列判断不正确的是( )
| A、与氢氧化钠反应的氯气一定为0.15mol |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、若反应中转移的电子为n mol,则n一定大于0.15mol |
| D、X:Y:Z可能为7:2:1 |
碱金属钫(Fr)具有放射性,下列对其性质的预言中,错误的是( )
| A、在碱金属元素中它的原子核对最外层电子的引力最大 |
| B、钫在空气中燃烧时,只生成化学式为Fr2O的氧化物 |
| C、它的氢氧化物化学式为FrOH,是一种极强的碱 |
| D、它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸 |
经过测定由C2H4O和C6H6组成的混合物中氧的质量分数为8%,则次混合物中碳的质量分数为( )
| A、8.5% | B、78% |
| C、14% | D、84% |
 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgN03溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgN03溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL,AgNO3溶液后,溶液中c(I-)>c(Cl-) |
| C、V2=2V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀可能变成黑色 |