题目内容
13.NA代表阿伏加德罗常数的值.下列叙述正确的是( )| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
分析 A、求出丙醇的物质的量,然后根据丙醇中含11条共价键来分析;
B、HCO3-在溶液中能电离为CO32-和水解为H2CO3;
C、求出二氧化碳的物质的量,然后根据二氧化碳和过氧化钠反应时,当1mol二氧化碳参与反应时,反应转移1mol电子;
D、H218O与D2O的摩尔质量均为20g/mol,且均含10个中子.
解答 解:A、60g丙醇的物质的量为1mol,而丙醇中含11条共价键,故1mol丙醇中含11NA条共价键,故A错误;
B、HCO3-在溶液中能电离为CO32-和水解为H2CO3,根据物料守恒可知,溶液中的HCO3-、CO32-、H2CO3之和为0.1NA个,故B错误;
C、标况下5.6L二氧化碳的物质的量为0.25mol,而二氧化碳和过氧化钠反应时,当1mol二氧化碳参与反应时,反应转移1mol电子,故当0.25mol二氧化碳反应时,转移0.25NA个电子,故C错误;
D、H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为0.1mol,且两者均含10个中子,故0.1mol混合物中含NA个中子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.生活中有很多化学问题.下列判断正确的是( )
| A. | 可乐饮料中含有的兴奋性物质咖啡因(C8H10O2N4)属于有机物 | |
| B. | 医疗上,碳酸氢钠是治疗胃穿孔的一种药剂 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 日常食用的冰糖、麦芽糖都属于单糖 |
8.下列说法正确的是( )
| A. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 |
18.下列说法正确的是( )
| A. | NaOH的摩尔质量是40g/mol | |
| B. | 1mol H2的质量与它的相对分子质量相等 | |
| C. | 1mol H2O在标准状况下的体积约为22.4L | |
| D. | 氧气的摩尔质量在数值上等于它的相对分子质量 |
5.以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10.0 ④石蕊5.0~8.0.现用0.1mol•L-1NaOH溶液滴定浓度相近的甲酸时,可用指示剂( )
| A. | 都可以用 | B. | 只能用③ | C. | 可以用①或② | D. | 可以用③或④ |
4.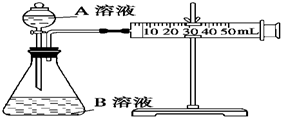 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下.
A、B的成分见下表:
(1)甲组同学实验探究的是浓度对化学反应速率的影响.
结合装置,分析所给实验仪器,定量比较①②组化学反应速率大小实现该实验目的还欠缺的仪器:秒表.
乙组通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢.所用的试剂以及条件如下表所示:
(2)①乙组同学实验目的是探究对化学反应速率的影响.
②写出溶液中发生的反应的离子方程式(提示:H2C2O4为弱酸,KMnO4的还原产物为Mn2+):2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.实验中该组同学始终没有看到溶液褪色,其原因是高锰酸钾过量.
丙组:丙组通过测定单位时间KMnO4溶液浓度变化来判定反应速率快慢.在25℃时,40mL 0.001mol/LKMnO4与38mL0.1mol/LH2C2O4和2mL2.38mol/LH2SO4混合液共80mL中KMnO4的浓度及对应时段的平均反应速率数据:
(3)完成上表中a=0.11 mol/(L•min).
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大.
你认为引起该反应速率增大的因素是反应过程中产生了催化剂加快了反应速率.
 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下.
A、B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
结合装置,分析所给实验仪器,定量比较①②组化学反应速率大小实现该实验目的还欠缺的仪器:秒表.
乙组通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢.所用的试剂以及条件如下表所示:
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
②写出溶液中发生的反应的离子方程式(提示:H2C2O4为弱酸,KMnO4的还原产物为Mn2+):2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.实验中该组同学始终没有看到溶液褪色,其原因是高锰酸钾过量.
丙组:丙组通过测定单位时间KMnO4溶液浓度变化来判定反应速率快慢.在25℃时,40mL 0.001mol/LKMnO4与38mL0.1mol/LH2C2O4和2mL2.38mol/LH2SO4混合液共80mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大.
你认为引起该反应速率增大的因素是反应过程中产生了催化剂加快了反应速率.