题目内容
17.室温下,取浓度相同的NaOH和HCl溶液,以3:1体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )| A. | 0.01 mol/L | B. | 0.02 mol/L | C. | 0.05 mol/L | D. | 0.06 mol/L |
分析 反应后溶液pH=12,则NaOH过量,根据c(OH-)=$\frac{c(碱)×V(碱)-c(酸)×V(酸)}{V(碱)+V(酸)}$以及反应后剩余离子的物质的量,计算酸碱混合后的体积计算原溶液的浓度.
解答 解:设原溶液物质的量浓度为cmol/L,V(NaOH)=3L,V(HCl)=1L,二者混合后反应,混合溶液体积为4L,
二者混合后反应,所得溶液pH=12,则 c(OH-)=10-2mol/L,
3L×cmol/L-1L×cmol/L=10-2mol/L×4L
则c=0.02mol/L;
故选B.
点评 本题考查溶液酸碱混合的计算,题目难度不大,注意酸碱混合时溶液pH的计算方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.NA 为阿伏加德罗常数,下列叙述正确的是( )
| A. | 22.4LCl2完全溶于水时转移的电子数为NA | |
| B. | 1 mol 甲基(-CH3)含有的电子数为9NA | |
| C. | 100g30%醋酸溶液中氢原子数为2NA | |
| D. | 100mL水中OH-的个数是10-8NA |
8.下列实验操作能够达到实验目的是( )
| A. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 | |
| D. | 在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |
5.下列叙述或离子方程式书写正确的是( )
| A. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-═SO42-+Cl-+2HClO | |
| B. | 向含有Fe2O3悬浊液中通入HI气体:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
12.能表示阿伏加德罗常数数值的是( )
| A. | 1 mol金属钠含有的电子数 | |
| B. | 0.012 kg 12C中含有的碳原子数 | |
| C. | 1 mol H2SO4完全溶于水后电离出的H+的个数 | |
| D. | 27 g Al与足量稀硫酸反应后生成H2的分子数 |
2.下列叙述不正确的是( )
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 二氧化硅是生产光导纤维的重要原料 | |
| D. | 稀HNO3和活泼金属反应时不能得到氢气 |
9.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.0gH2O与D2O的混合物中所含中子数为NA | |
| B. | 标准状况下1.4 g乙烯所含共用电子对数为0.25NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 | |
| D. | 50ml 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
6.亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白.NaClO2溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氧微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )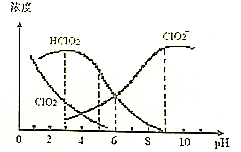

| A. | 向亚氯酸钠溶液加水稀释,溶液中n(ClO2)增大 | |
| B. | HClO2的电离平衡常数Ka=1.0×10-6 | |
| C. | NaClO2溶液中:c(Na+)+c(H+)>c(ClO2-)+c(Cl-) | |
| D. | pH=5时含氯元素的微粒浓度大小关系为:c(HClO2)>c(ClO2-)>c(Cl-)>c(ClO2) |
17.下列分离方法不正确的是( )
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用分液的方法分离食盐水和汽油的混合物 |