题目内容
11.下列4组物质均有一种物质的类别与其它三种不同A、HCl、H2SO4、NH4NO3、HNO3 B、N2、C、Fe、P
C、Zn、Fe、Al、Cl2 D、MgO、Na2O、CuO、CO
以上四组物质中与其它3种类别不同的物质依次是(填化学式)
A、NH4NO3
B、Fe
C、Cl2
D、CO.
分析 A、从物质所属的类别分析HCl、H2SO4、NH4NO3、HNO3的区别;
B、从组成物质的元素是金属元素还是非金属元素上分析N2、C、Fe、P的区别;
C、从组成物质的元素是金属元素还是非金属元素上分析Zn、Fe、Al、Cl2
D、从两种组成元素的区别上分析MgO、Na2O、CuO、CO.
解答 解;A、HCl、H2SO4、HNO3都属于酸,但是NH4NO3属于盐,故答案为:NH4NO3.
B、N2、C、P属于非金属单质,但是Fe属于金属单质,故答案为:Fe;
C、Zn、Fe、Al属于金属单质,Cl2属于非金属单质,故答案为:Cl2;
D、MgO、Na2O、CuO属于金属氧化物,但是CO属于非金属氧化物,故答案为:CO.
点评 本题考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物、氧化物、酸、碱、盐等基本概念,并能够区分应用.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
19.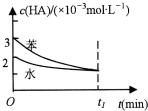 常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
 常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )| A. | HA在水中的电离速率大于其在苯中的双聚速率 | |
| B. | t1时刻在水中和苯中c(A-)相同 | |
| C. | 向上述的混合体系中加入少量水和苯的混合物,则两平衡均正移,c(HA)均减小 | |
| D. | 用10mL 0.05mol•L-1的NaOH溶液可恰好中和混合体系中的HA |
6.下列物质中,能够导电的电解质是( )
| A. | Cu丝 | B. | 熔融的MgCl2 | C. | 酒精 | D. | 蔗糖 |
16.下列溶液一定呈碱性的是( )
| A. | c(OH-)<c(H+) | B. | 溶液中c(OH-)>c(H+) | ||
| C. | c(OH-)=c(H+) | D. | c(OH-)>1×10-7mol/L |
20.pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值.如某溶液中某溶液的浓度为1×10-3mlo/L,则该溶液中该溶质的pC=-1g(1×10-3)=3.如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mlo/L,可认为该离子不存在).下列说法不正确的是( )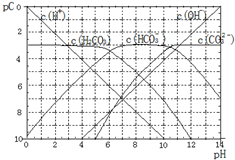

| A. | 某温度下,CO2饱和溶液的浓度是0.05mol•L-1,其中$\frac{1}{5}$的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% | |
| B. | 25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6 | |
| C. | 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$) | |
| D. | 25℃时,0.1mol/LNa2CO3中C(HCO${\;}_{3}^{-}$)比0.1mol/LH2CO3中C(HCO${\;}_{3}^{-}$)大 |
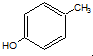 对甲基苯酚与溴水反应
对甲基苯酚与溴水反应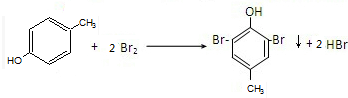
 环已二烯与氯气1,4加成
环已二烯与氯气1,4加成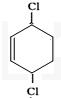
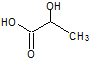 乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$
乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$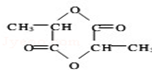 +2H2O
+2H2O .
.