题目内容
6.气态时,Ti2+、Ti3+、Ti中半径最大的是Ti,电离出第一个电子所需能量最大的是Ti3+.气态时,F-、O2-、Na+中半径最大的是O2-,电离出第一个电子所需能量最大的是Na+.分析 同核单原子形成的微粒,其半径大小比较的规律为:核外电子数越多,其半径越大.钛是22号元素,写出其基态核外电子排布,然后判断其基态价电子,根据价电子电离出第一个电子所需能量最大的微粒,同核外电子排布的单原子微粒,核电荷数越大,半径越小,F-、O2-、Na+中,Na+-电离出第一个电子所需能量最大.
解答 解:原子的半径与核外电子运动的范围有关,同核单原子形成的微粒,核内质子数相同,核外电子数越多,其半径越大,所以气态时,Ti2+、Ti3+、Ti中半径最大的是Ti,钛是22号元素,Ti核外有22个电子,根据构造原理知其基态核外电子排布为:1s22s22p63s23p63d24s2,外围电子排布式为:3d24s2,可易形成Ti2+、Ti3+、Ti4+,且电离能逐渐增大,所以电离出第一个电子所需能量最大的是Ti3+,F-、O2-、Na+,核外电子排布都为:1s22s22p6,同核外电子排布的单原子微粒,核电荷数越大,半径越小,所以半径最大的是O2-,F-、O2-都为得到电子形成的微粒,Na+为失去电子形成的微粒,核外电子排布相同,但Na+半径最小,原子核对外层电子吸引能力最强,电离出第一个电子所需能量最大,
故答案为:Ti;Ti3+;O2-;Na+.
点评 本题考查电离能和微粒半径大小比较,掌握同核单原子形成的微粒、同核外电子排布的单原子微粒半径大小比较的规律以及电离能大小比较方法是解答关键,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
20.相等质量的铜分别与足量的稀硝酸和浓硝酸完全反应,下列说法正确的是( )
| A. | 两者生成硝酸铜的物质的量不同 | |
| B. | 浓硝酸产生的气体更少 | |
| C. | 稀硝酸被还原之后的生成物的价态更低,所以稀硝酸的氧化性更强 | |
| D. | 两个反应中的电子转移的数目相同 |
1.化学与生活、社会发展息息相关,下列有关说法正确的是( )
| A. | 侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了分解反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
15.下列说法正确的是( )
| A. | 需要加热才能发生的反应是吸热反应 | |
| B. | 化学反应中的能量变化只表现为热量变化 | |
| C. | 当反应物的总能量高于生成物的总能量时,通常发生放热反应 | |
| D. | 当反应物的总能量高于生成物的总能量时,通常发生吸热反应 |
16.如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表.
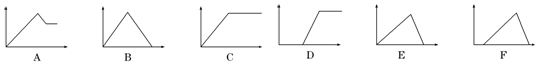

| 溶液 | 加入的物质 | 字母代号 |
| ①饱和石灰水 | 通过量CO2 | B |
| ②AlCl3溶液 | 通过量NH3 | C |
| ③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | A |
| ④AlCl3溶液 | 逐滴加NaOH溶液至过量 | E |
| ⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | F |
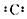 B-的结构示意图
B-的结构示意图 C+的电子式Na+
C+的电子式Na+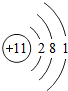 ;铝原子的结构示意图是
;铝原子的结构示意图是 .
.