题目内容
14.已知下列两个热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 220kJ•mol-1
根据上面两个热化学方程式,试回答下列问题:
(1)H2的燃烧热为285.8 kJ•mol-1,C3H8的燃烧热为2220 kJ•mol-1.
(2)1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为4725.8 kJ.
(3)已知:H2O(l)═H2O(g)△H=+44.0kJ•mol-1,试写出丙烷燃烧生成CO2和水蒸气时的热化学方程式C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
分析 (1)燃烧热是指1 mol 可燃物完全燃烧生成稳定化合物所放出的热量,单位为kJ•mol-1;
(2)根据氢气物质的量以及燃烧热、丙烷物质的量以及燃烧热,列式求出混合气体完全燃烧释放的热量;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式.
解答 解:(1)2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,2molH2在O2中完全燃烧生成2.00mol液态H2O放出571.6kJ的热量,所以1mol氢气完全燃烧放出热量为571.6KJ×$\frac{1}{2}$=285.8KJ,H2的燃烧热为285.8 kJ•mol-1,C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1,C3H8的燃烧热为2220 kJ•mol-1,
故答案为:285.8 kJ•mol-1;2220 kJ•mol-1;
(2)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为1mol×285.8kJ•mol-1+2mol×2220kJ•mol-1=4725.8kJ,
故答案为:4725.8kJ;
(3)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ/mol
②H2O(1)=H2O(g)△H=+44.0kJ/mol
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol.
点评 本题考查了热化学方程式书写和盖斯定律计算应用,化学反应热的有关计算分析,燃烧热概念分析应用,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. |  用装置除去Cl2中含有的少量HCl气体 | |
| B. |  用装置制取少量O2时,能做到“随开随停” | |
| C. |  若装置中X为CCl4,则可用于吸收NH3或HCl | |
| D. |  用装置比较氯、碳、硅三种元素的非金属性强弱 |
| A. | Al(OH)3(s)+NaOH(aq)═NaAlO2(aq)+2H2O(aq)△H<0 | |
| B. | CH3CH3OH(l)+3O2(g)-→2CO2(g)+3H2O(l)△H<0 | |
| C. | CO2(g)+C(g)═2CO(g)△H>0 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H<0 |

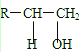 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应