题目内容
4.丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1、电解质是熔融碳酸盐(K2CO2或NaCO3)负级r总反应方程式:
正极:O2+2CO2+4e-=2CO32-负极:C3H8-20e-+10CO32-=13CO2+4H2O
总反应方程式:C3H8+5O2═3CO2+4H2O
2、酸性电解质(电解液H2SO4溶液)
总反应方程式:C3H8+5O2═3CO2+4H2O
3、碱性电解质(铂为两极、电解液KOH溶液)
正极:O2+4e-+4OH-=2H2O负极:C3H8-20e-+26OH-=3CO32-+17H2O.
分析 1.丙烷燃料电池中,电解质是熔融碳酸盐时,电解质不会与产物二氧化碳反应,总反应为C3H8+5O2═3CO2+4H2O,负极上燃料失电子,发生氧化反应,则负极的电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极上氧气得电子发生还原反应,正极的反应式为:O2+2CO2+4e-=2CO32-;
2.酸性电解质中,产物二氧化碳不会与电解质反应,则总反应不变;
3.碱性电解质中,二氧化碳与KOH反应生成碳酸钾和水,据此分析.
解答 解:1.丙烷燃料电池中,电解质是熔融碳酸盐时,电解质不会与产物二氧化碳反应,总反应为C3H8+5O2═3CO2+4H2O,负极上燃料失电子,发生氧化反应,则负极的电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极上氧气得电子发生还原反应,正极的反应式为:O2+2CO2+4e-=2CO32-,
故答案为:O2+2CO2+4e-=2CO32-;C3H8-20e-+10CO32-=13CO2+4H2O;C3H8+5O2═3CO2+4H2O;
2.酸性电解质中,产物二氧化碳不会与电解质反应,则总反应不变,为C3H8+5O2═3CO2+4H2O,
故答案为:C3H8+5O2═3CO2+4H2O;
3.碱性电解质中,二氧化碳与KOH反应生成碳酸钾和水,负极反应为:C3H8-20e-+26OH-=3CO32-+17H2O,正极反应为:O2+4e-+4OH-=2H2O,
故答案为:O2+4e-+4OH-=2H2O;C3H8-20e-+26OH-=3CO32-+17H2O.
点评 本题考查了原电池原理,知道燃料电池中正负极上发生反应的物质是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 汽油与水不相溶,可以用裂化汽油萃取溴水中的溴 | |
| B. | 石油含有烷烃、环烷烃、芳香烃,煤含有苯、甲苯、二甲苯等有机物 | |
| C. | 煤的气化、液化是使煤变成清洁能源,减小环境污染的有效途径 | |
| D. | 沸点范围:汽油>煤油>柴油>重油 |
12.只有阳离子而没有阴离子的晶体是( )
| A. | 分子晶体 | B. | 金属晶体 | C. | 原子晶体 | D. | 离子晶体 |
19.下列关于化学键的说法不正确的是( )
| A. | 并不是所有物质都含有化学键 | B. | 只有非金属原子间才能形成共价键 | ||
| C. | 单质不可能含有离子键 | D. | 共价化合物中不可能含有离子键 |
9.下列关于0.2mol•L-1的Ca(NO3)2溶液的叙述中,不正确的是( )
| A. | 100mL的该溶液中含3.28g溶质 | |
| B. | .500mL的该溶液中含0.2molNO3- | |
| C. | 600mL的该溶液中Ca2+与NO3的物质的量浓度之比是1:2 | |
| D. | .800nmL的该溶液中NO3-的总浓度为3.2mol•L-1. |
6.用石墨电极电解CuCl2溶液(见图),下列分析正确的是( )
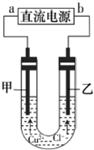

| A. | b端是直流电源的负极 | |
| B. | 用湿润的KI一淀粉试纸检验甲电极产物 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
3.下列说法错误的是( )
| A. | 用铜制作印刷电路是利用了铜的还原性 | |
| B. | 利用铝热反应来焊接钢轨 | |
| C. | 羊毛、蚕丝、棉花的主要成分都是纤维素 | |
| D. | 生铁和普通钢都是铁碳合金 |
4.如图所示变化为吸热反应的是( )
| A. | 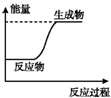 | B. | 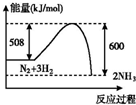 | C. |  | D. |  |



