题目内容
4.如图所示变化为吸热反应的是( )| A. | 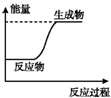 | B. | 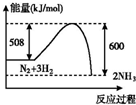 | C. | 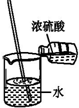 | D. |  |
分析 A.图中中反应物能量低于生成物,为吸热反应;
B.氮气和氢气能量总和大于氨气能量,反应为放热反应;
C.浓硫酸溶于水溶液温度升高;
D.稀盐酸和锌发生氧化还原反应,反应过程中放热.
解答 解:A.图象分析可知,反应物能量小于生成物,反应为吸热反应,故A正确;
B.图象表示的氮气和氢气能量总和大于生成的氨气能量,反应为放热反应,故B错误;
C.浓硫酸慢慢到入水中溶解稀释,过程中放出热量,故C错误;
D.稀盐酸滴入盛锌粒的试管中发生置换反应,反应属于氧化还原反应,过程中放出热量,故D错误;
故选A.
点评 本题考查了化学反应能量变化、浓硫酸稀释等,注意反应前后能量守恒的分析应用,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
12.如图是以烃A为原料生产人造羊毛的合成路线.下列说法正确的是( )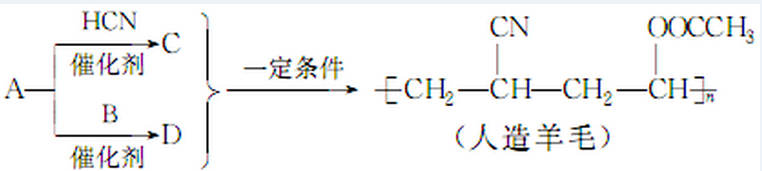
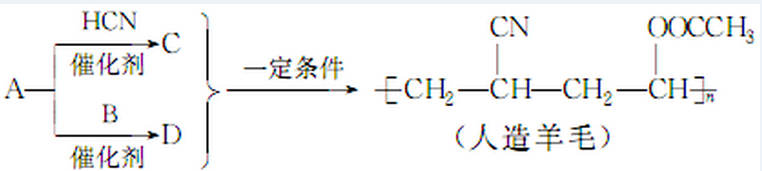
| A. | 合成人造羊毛的反应属于缩聚反应 | B. | A生成C的为反应属于加成反应 | ||
| C. | A生成D的反应属于取代反应 | D. | 烃A的结构简式为CH2=CH2 |
9.“西气东输”工程所输送的气体的主要成分是( )
| A. | 甲烷 | B. | 乙烯 | C. | 一氧化碳 | D. | 乙炔 |
16.下列反应的离子方程式不正确的是( )
| A. | Cl2与稀NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | Fe2(SO4)3和KI溶液反应:Fe3++2I-═Fe2++I2 | |
| C. | 烧碱溶液中加入铝片:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
14.H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等.

(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2,Na2O2的电子式为 .
.
(2)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为O2+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2O2
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是H2O2使病毒蛋白质发生变性,失去活性.
(4)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
填写表中缺少的内容:Ⅱ12%;Ⅲ1.0;Ⅳ催化剂对反应速率的影响.
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的正极(选填:“正”或“负”);纳米棒向右(选填:“左”或“右”)移动.
(6)断裂1mol过氧化氢中的O-O键和氧气中的O=O键所需的能量依次分别为142kJ•mol-1、497.3kJ•mol-1.则反应2H2O2(l)═2H2O(l)+O2(g)△H=-213.3kJ•mol-1.

(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2,Na2O2的电子式为
 .
.(2)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为O2+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2O2
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是H2O2使病毒蛋白质发生变性,失去活性.
(4)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
| 试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
| 质量 分数 | 体积/mL | |||||
| Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
| Ⅱ | 温度对反应速率的影响 | 5.0 | 60℃ | 0 | 0 | |
| Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | 0 | |
| Ⅳ | 4.0% | 5.0 | 常温 | 0 | 1.0 | |
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的正极(选填:“正”或“负”);纳米棒向右(选填:“左”或“右”)移动.
(6)断裂1mol过氧化氢中的O-O键和氧气中的O=O键所需的能量依次分别为142kJ•mol-1、497.3kJ•mol-1.则反应2H2O2(l)═2H2O(l)+O2(g)△H=-213.3kJ•mol-1.

 .
.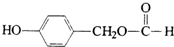 ;H:
;H: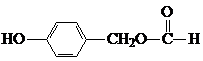 .
.