题目内容
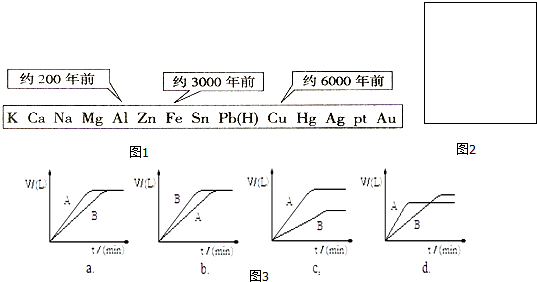
12.短周期元素W、X、Y、Z是原子序数依次增大的同一周期主族元素,W、X是金属,Y、Z是非金属元素.请回答下列问题:(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
(2)W与Y可形成化合物W2Y,该化合物的电子式为
 .
.(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是S 2->Cl->Na+>Al3+.
(5)Z的最高价氧化物为无色液体,该物质与水可发生反应.写出该反应的化学方程式:Cl2O7+H2O=2HClO4.
分析 W、X、Y、Z是原子序数依次增大的同一周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
(5)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸.
解答 解:W、X、Y、Z是原子序数依次增大的同一周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X为金属,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则为NaOH和Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S,Na2S的电子式为: ,故答案为:
,故答案为: ;
;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl,反应化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径大小顺序是:S 2->Cl->Na+>Al3+,
故答案为:S 2-;Cl-;Na+;Al3+;
(5)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸,化学反应方程式为:Cl2O7+H2O=2HClO4,故答案为:Cl2O7+H2O=2HClO4.
点评 本题考查结构性质位置关系应用,涉及电子式、微粒半径比较、元素周期律应用、化学方程式书写等,正确推断元素是解本题关键,注意掌握微粒半径大小的比较方法.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | 电池工作时,锌失去电子,锌是负极 | |
| B. | 电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| A. | 煤的气化与液化 | B. | 液体燃料呈雾状喷出 | ||
| C. | 通入大量的空气 | D. | 将煤块粉碎 |
| A. | 10mL 质量分数为98%硫酸,用10mL 水稀释后,硫酸的质量分数小于49% | |
| B. | 向两等份不饱和的烧碱溶液中分别加入一定量的氧化钠和过氧化钠,使溶液均恰好饱和,则加入的氧化钠和过氧化钠的物质的量之比等于1:1(温度不变) | |
| C. | 36.5 克HCl 溶解在1L 水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质的量溶液为c mol/L,则ω=36.5c/ρ | |
| D. | 上述36.5g HCl 气体占有的体积约为22.4L |
 已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物.
已知在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物. ;
; 与
与
 .
.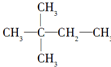 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2. C:CH3COOH
C:CH3COOH