题目内容
10.下列叙述正确的是( )| A. | 构成分子晶体的粒子中一定含有共价键 | |
| B. | 在离子晶体中不可能存在非极性键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
分析 A.稀有气体形成的晶体为分子晶体;
B.离子晶体中可能存在非极性键;
C.离子化合物中可能含有共价键;
D.原子晶体二氧化銈中含有极性硅氧键.
解答 解:A.稀有气体形成的晶体为分子晶体,不含化学键,故A错误;
B.离子晶体中可能存在非极性键,如过氧化钠中含氧氧非极性键,故B错误;
C.离子化合物中可能含有共价键,如过氧化钠和氢氧化钠中,故C正确;
D.原子晶体二氧化銈中含有极性硅氧键,所以可能存在极性共价键,故D错误;
故选C.
点评 本题考查化学键及化合物的类别,为高频考点,把握常见物质中的化学键及形成化学键的一般规律,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列说法正确的是( )
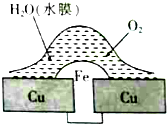

| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
5.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
| A. | NO(NO2)--通入足量水中,再用向上排空气法收集气体 | |
| B. | NaHCO3溶液(Na2CO3)--通入过量CO2 | |
| C. | Cl2(HCl)--用排饱和NaCl溶液的方法收集气体 | |
| D. | CuO(C)--直接在空气中加热 |
15.通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一.下列由实验现象得出正确结论的是( )
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18gH2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2 NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与过量稀硫酸反应失去电子数为0.3 NA |
 (1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$;
(1)列出可逆反应Br2+H2O?H++Br-+HBrO的平衡常数的表达式:K=$\frac{c(HBrO)c(Br{\;}^{-})c(H{\;}^{+})}{c(Br{\;}_{2})}$; ;
; .
. .
.