题目内容
10.下列有关电解质溶液中粒子浓度关系正确的是( )| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1 mol/L Na2C2O4与0.1 mol/L HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
分析 A.根据硫酸氢钠溶液中的电荷守恒、物料守恒判断;
B.碘化银更难溶,则氯离子浓度大于银离子;
C.根据混合液中的物料守恒判断;
D.二者恰好反应生成NaHC2O4和氯化钠,根据电荷守恒判断.
解答 解:A.pH=1的NaHSO4溶液中,根据电荷守恒可知:c(Na+)+c(H+)=2c(SO42-)+c(OH-),根据物料守恒可知:c(Na+)=c(SO42-),二者结合可得:c(H+)=c(SO42-)+c(OH-),故A正确;
B.含有AgCl和AgI固体的悬浊液,由于碘化银更难溶,则:c(Cl-)>c(I-),故B错误;
C.CH3COONa和CaCl2混合溶液中,根据物料守恒可得:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故C错误;
D.0.1mol/L Na2C2O4与0.1 mol/L HCl溶液等体积混合(H2C2O4为二元弱酸),根据电荷守恒可知:2c(C2O42-)+c(HC2O4-)+c(Cl-)+c(OH-)=c(Na+)+c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义及应用方法为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
20.由短周期元素和长周期元素共同组成的族可能是( )
| A. | 主族 | B. | 副族 | C. | Ⅷ族 | D. | ⅦB族 |
1.下列过程中,共价键被破坏的是
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl分解⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl分解⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.( )
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
18.关于下列各装置图的叙述中,不正确的是( )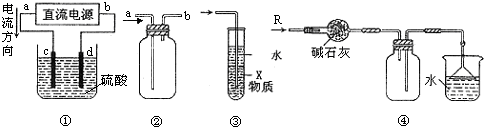

| A. | 装置①中,c、d分别为石墨电极,则c极得到O2、d极得到H2 | |
| B. | 装置②可用于收集NO气体 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氯化氢,并防止倒吸 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
15.二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别是:
由上述数据可推断,熔点为-54℃的二甲苯的名称是( )
| 一溴代二甲苯 | 234℃ | 20℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
| 对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
| A. | 邻二甲苯 | B. | 间二甲苯 | C. | 对二甲苯 | D. | 无法确定 |
2.在消毒剂家族中,臭氧和过氧乙酸的贡献并驾齐驱.O3可以看成是一个O2分子携带一个O原子,利用其自身的强氧化性杀灭病菌,反应后放出无污染的O2.下列关于O3说法中正确的是( )
| A. | O3与O2互为同分异构体 | B. | O3与O2互为同素异形体 | ||
| C. | 使用时浓度大小对人体无害 | D. | O3遇氟氯烷烃不会分解 |
19.常温下用0.1000mol•L-1Na0H溶液滴定20.00mol某未知浓度的醋酸溶液,滴定曲线如图.
已知①点所示溶液中c(CH3COO-)=2c(CH3C00H),
③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应.
下列说法不正确的是( )
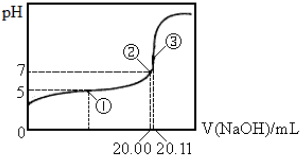
已知①点所示溶液中c(CH3COO-)=2c(CH3C00H),
③点表示Na0H溶液与未知浓度的醋酸溶液恰好完全反应.
下列说法不正确的是( )

| A. | 该温度下CH3COOH的电离平衡常数Ka=2.0×10-5 | |
| B. | ③点所示溶液中:c(CH3C00-)+c(CH3C00H)=(Na+)+c(0H-) | |
| C. | 该醋酸的浓度为0.1006mol•L-1 | |
| D. | 由图示可以计算醋酸钠的水解平衡常数为5.0×10-10 |
20.复分解反应中有一规律:强酸与弱酸盐反应可以生成弱酸(如2HCl+CaCO3=CaCl2+H2O+CO2↑);在常温下,测得下列酸溶液(浓度均为a%)酸性强弱顺序:H2SO4>HCl>H2S>H2CO3>HClO;下列反应均能发生,其中不符合该规律的是( )
| A. | H2SO4+2NaHCO3═2NaCl+2H2O+2CO2↑ | B. | 2HCl+BaS═BaCl2+H2S↑ | ||
| C. | CO2+H2O+Ca(ClO)2═CaCO3↓+2HClO | D. | H2S+CuSO4═CuS↓+H2SO4 |
 有如图所示的装置:
有如图所示的装置: