题目内容
15.实验室中,用20mL浓度为3mol/L的稀硫酸与过量的锌粒反应,在一定温度下发生反应制取氢气,为了降低反应速率,但又不影响生成氢气的总量,下列措施能达到目的是( )| A. | 向稀硫酸中加硫酸钾溶液 | B. | 将锌粒制成薄锌片 | ||
| C. | 向稀硫酸中加碳酸钠固体 | D. | 向稀硫酸中加硝酸钾溶液 |
分析 过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.
解答 解:A.加硫酸钾溶液,不反应,由于体积变大,减小氢离子浓度但不改变其物质的量,反应速率减小,生成氢气的量不变,故A正确;
B.将锌粒制成薄锌片,固体表面积增大,反应速率增大,生成氢气的总量不变,故B错误;
C.碳酸钠与硫酸反应生成二氧化碳,减少生成氢气的量,故C错误;
D.硝酸根离子在酸性条件下具有强氧化性,可与锌反应生成NO气体而不生成氢气,故D错误.
故选A.
点评 本题考查影响化学反应速率的因素,为高频考点,注意信息中Zn过量及浓度对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
5.广州亚运会火炬“潮流”所用燃料的主要成分是丙烷,下列说法不正确的是( )
| A. | 分子中的所有碳原子不在同一条直线上 | |
| B. | 在光照条件下,可与Cl2发生取代反应 | |
| C. | 丙烷的沸点比丁烷的沸点高,更易液化 | |
| D. | 丙烷难溶于水,且密度小于水 |
3.常温下将0.1mol的Cl2通入0.5L的水中(不计溶液体积变化),制得氯水,关于这份氯水下列说法正确的是( )
| A. | 若不考虑HClO和H20的电离,该溶液中H+的浓度为0.1mol/L | |
| B. | 若在该溶液中加入足量Na0H,则可得到0.1mol的NaClO | |
| C. | 若将此溶液在强光下光照,产生气泡,则气泡主要成分是O2 | |
| D. | 此溶液久置后,由于HClO的大量分解,会导致其pH值升高 |
10.用惰性电极电解下列溶液时在阴阳两极收集到的气体体积比为2:1的是( )
| A. | H2SO4 | B. | HCl | C. | AgNO3 | D. | NaOH |
20.随着人民群众生活水平的提高,居窒的装饰,装修成为必需,研究表明,造成室内空气污染的主要元料、人造板、油漆、黏合剂等材料中的甲醛和苯酚等有机物,绝大多数这些有机物有致癌或促癌作用生命健康,有同学建议装修之后采取以下措施.你认为最适宜的是( )
| A. | 放一大盆水于室内 | B. | 放一大盆苯于室内加以溶解吸收 | ||
| C. | 洒一些酸性KMnO4溶液于地面 | D. | 打开窗户,长时间通风 |
5.已知0.1mol/L的二元酸H2B溶液的pH=4.0,则下列说法中正确的是( )
| A. | 在Na2B、NaHB两溶液中,离子种类不相同 | |
| B. | 二元酸H2B为强酸 | |
| C. | 在NaHB溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-) | |
| D. | 在Na2B溶液中一定有:c(Na+)>c(B2-)>c(H+)>c(OH-) |
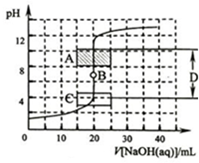 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.