题目内容
 如图是部分元素在元素周期表中位置,根据下列要求回答问题:
如图是部分元素在元素周期表中位置,根据下列要求回答问题:(1)在这些元素中,最高价氧化物的水化物中,酸性最强的化合物的化学式:
(2)用电子式表示元素c与d形成的高价化合物的过程:
(3)根据元素周期表结构推知,53号元素在周期表中的位置是
(4)假设53号元素用X表示,它的气态氢化物稳定性比砹的气态氢化物稳定性
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知a为H、b为B、c为C、d为O、e为F、f为Na、g为Al、h为P、i为Fe、j为Cu.
(1)氟元素没有最高价含氧酸,上述元素中P元素非金属性最强,故磷酸的酸性最强;上述元素中Na的金属性最强,故NaOH碱性最强,氧化钠由钠离子与氢氧根离子构成;
(2)元素c与d形成的高价化合物为CO2,分子中C原子与O原子之间产生2对共用电子对,用C原子、O原子电子式表示其形成;
(3)由各周期容纳元素种数,53-2-8-8-18=17,故处于第五周期、17列;
(4)X处于第五周期、17列,即处于第三周期第VIIA族,同主族自上而下非金属性减弱,氢化物稳定性减弱,其最高正化合价等于族序数,根据化合价书写其最高价氧化物化学式.
(1)氟元素没有最高价含氧酸,上述元素中P元素非金属性最强,故磷酸的酸性最强;上述元素中Na的金属性最强,故NaOH碱性最强,氧化钠由钠离子与氢氧根离子构成;
(2)元素c与d形成的高价化合物为CO2,分子中C原子与O原子之间产生2对共用电子对,用C原子、O原子电子式表示其形成;
(3)由各周期容纳元素种数,53-2-8-8-18=17,故处于第五周期、17列;
(4)X处于第五周期、17列,即处于第三周期第VIIA族,同主族自上而下非金属性减弱,氢化物稳定性减弱,其最高正化合价等于族序数,根据化合价书写其最高价氧化物化学式.
解答:
解:由元素在周期表中位置,可知a为H、b为B、c为C、d为O、e为F、f为Na、g为Al、h为P、i为Fe、j为Cu.
(1)氟元素没有最高价含氧酸,上述元素中P元素非金属性最强,故磷酸的酸性最强,其化学式为:H3PO4;上述元素中Na的金属性最强,故NaOH碱性最强,氧化钠由钠离子与氢氧根离子构成,其电子式为: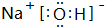 ,故答案为:H3PO4;
,故答案为:H3PO4;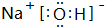 ;
;
(2)元素c与d形成的高价化合物为CO2,分子中C原子与O原子之间产生2对共用电子对,用C原子、O原子电子式表示其形成过程为: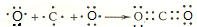 ,
,
故答案为: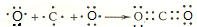 ;
;
(3)由各周期容纳元素种数,53-2-8-8-18=17,故处于第五周期、17列,即处于第三周期第VIIA族,故答案为:第三周期第VIIA族;
(4)X处于第三周期第VIIA族,同主族自上而下非金属性减弱,氢化物稳定性减弱,故氢化物稳定性HI>HAt,其最高正化合价为+7,最高价氧化物化学式为:I2O7,故答案为:强;I2O7.
(1)氟元素没有最高价含氧酸,上述元素中P元素非金属性最强,故磷酸的酸性最强,其化学式为:H3PO4;上述元素中Na的金属性最强,故NaOH碱性最强,氧化钠由钠离子与氢氧根离子构成,其电子式为:
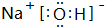 ,故答案为:H3PO4;
,故答案为:H3PO4;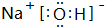 ;
;(2)元素c与d形成的高价化合物为CO2,分子中C原子与O原子之间产生2对共用电子对,用C原子、O原子电子式表示其形成过程为:
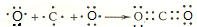 ,
,故答案为:
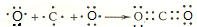 ;
;(3)由各周期容纳元素种数,53-2-8-8-18=17,故处于第五周期、17列,即处于第三周期第VIIA族,故答案为:第三周期第VIIA族;
(4)X处于第三周期第VIIA族,同主族自上而下非金属性减弱,氢化物稳定性减弱,故氢化物稳定性HI>HAt,其最高正化合价为+7,最高价氧化物化学式为:I2O7,故答案为:强;I2O7.
点评:本题考查元素周期表与元素周期律,难度中等,注意掌握用电子式表示物质或化学键的形成,掌握根据原子序数确定元素在周期表中位置.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应的离子方程式书写不正确的是( )
| A、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3?H2O+H2O |
| B、碘化钾与适量溴水反应:2I-+Br2═I2+2Br- |
| C、硫化钾的水解:S2-+2H2O?H2S+2OH- |
| D、向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
将5.1g Mg、Al合金溶解在过量的500mL 2mol/L的盐酸中,然后加入4mol/L NaOH溶液.若要使生成的沉淀最多,则应加入的这种NaOH溶液的体积是( )
| A、200mL |
| B、250mL |
| C、425mL |
| D、560mL |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )


| A、可用KI淀粉试纸和食醋检验加碘盐中是否含有碘 |
| B、足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O═2HClO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1mol I2,反应中转移的电子数为10NA |
以保护环境和垃圾资源化为目的,下列垃圾属于同类物质的是( )
| A、废铜烂铁、废塑料 |
| B、废电池、易拉罐 |
| C、废报纸、硬纸板 |
| D、塑料袋、空酒瓶 |
 A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体.
A、B、C、D、E均是中学常见的纯净物.其转化关系如图所示(图中某些生成物已略去),物质A与物质B之间的反应不在溶液中进行,通常状况下D为气体. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表: