题目内容
6.下列物质属于非电解质一组的是( )| A. | CO2、NH3、CH4 | B. | H2SO4、HNO3、BaCl2 | ||
| C. | CO2、NH3、Cu | D. | KNO3、NaOH、HCl |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
电解质、非电解质都是化合物,所以单质、混合物既不是电解质,也不是非电解质.
解答 解:A.CO2、NH3、CH4本身都不能电离产生自由移动的离子,都是化合物,所以都是非电解质,故A正确;
B.H2SO4、HNO3、BaCl2在水溶液中或熔融状态下能导电的化合物,都是电解质,故B错误;
C.铜是单质,不是非电解质,故C错误;
D.KNO3、NaOH、HCl在水溶液中或熔融状态下能导电的化合物,都是电解质,故D错误;
故选:A.
点评 本题考查了非电解质的概念,抓住非电解质的特征在水溶液中和熔融状态下都不能够导电的原因是自身不能电离是解题的关键,题目难度不大,注意单质、混合物既不是电解质,也不是非电解质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.在溶液中加入足量的过氧化钠后仍能大量共存的离子组是( )
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、S2- |
17.以下有关物质的量浓度的叙述正确的是( )
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{4.0×74.5}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
14.某密闭容器中,A(s)+3 B(g)?2 C(g)+D(g)△H>0在一定条件下达到平衡,下列说法正确的是( )
| A. | 加入少量A,B的转化率增大 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 增大压强,平衡不移动,正、逆反应速率不变 | |
| D. | 加入催化剂,反应速率增大,平衡常数不变 |
1.将足量的两份铝,分别加入到等物质的量的盐酸和氢氧化钠溶液中,放出气体的物质的量之比为( )
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 1:3 |
5. 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 乙烧杯发生的反应:HSO3--2e-+H2O═SO42-+3H+ | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 | |
| D. | 外电路的电子方向是从b到a |
6.下列离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀铜板:Fe3++2Cu═Fe2++2Cu2+ | |
| B. | 向1 mol/L硝酸溶液中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 在明矾溶液中滴加过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
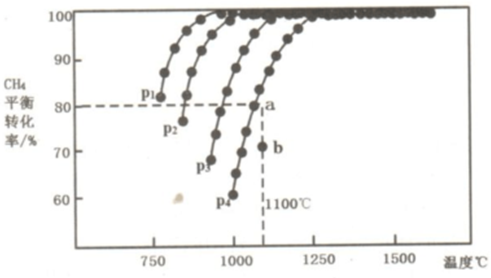
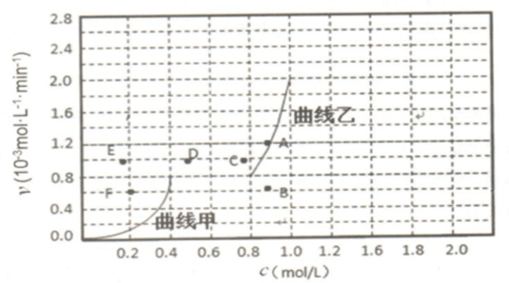
 .
.