题目内容
关于KOH溶液和Fe(OH)3胶体描述正确的是
A.两者的分散质都属于碱
B.两者均为有色不透明的分散系
C.两者分散质的直径都介于10-9 ~10-7m之间
D.一束光线分别通过时,两者都会出现明显的光带
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.X、T、Y、Z为1-36号元素,且原子序数依次增大,四种元素的性质或结构信息如表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图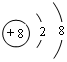 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
(2)Y单质与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
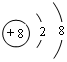 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.(2)Y单质与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
20.足量Zn粉与50ml、0.1mol/L的稀硫酸充分反应.为了减慢此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加Na2SO4溶液;②改用50ml、0.1mol/L的稀盐酸;③改用50ml、0.05mol/L的硝酸;④加适量Na2CO3溶液;⑤冰水浴.
①加Na2SO4溶液;②改用50ml、0.1mol/L的稀盐酸;③改用50ml、0.05mol/L的硝酸;④加适量Na2CO3溶液;⑤冰水浴.
| A. | ① | B. | ①⑤ | C. | ①②⑤ | D. | ①②③⑤ |
17.下列各项实验操作中正确的是( )
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 在蒸馏时应先打开冷凝水开关,待水充满后再点燃酒精灯 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,然后换一个烧杯将上层液体放出 | |
| D. | 在做蒸馏实验时应将温度计的水银球浸没在液体里 |
常温下,1mol化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是( )
共价键 | H—H | F—F | H—F | H—Cl | H—I |
E/(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432kJ·mol-1>E(H—Br)>298kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)→2H(g)△H=+436kJ·mol-1
D.H2(g)+F2(g)=2HF(g)△H=-25kJ·mol-1
3.现有反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(2)已知在一定温度下:
C(s)+CO2(g)?2CO (g) 平衡常数K1;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K;
则K1、K2、K之间的关系是K=$\frac{{K}_{2}}{{K}_{1}}$.
(3)某催化反应室中发生的反应为:
CH4(g)+H2O(g)═CO(g)+3H2(g)△H1=+216kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H2
已知CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-44kJ•mol-1,则△H2=+260 kJ•mol-1.
(4)某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如表:
①写出大试管中发生反应的化学方程式:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,该反应是放热反应(填放热或吸热).
②实验结果表明,催化剂的催化效果与催化剂接触面积 有关.
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(2)已知在一定温度下:
C(s)+CO2(g)?2CO (g) 平衡常数K1;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K;
则K1、K2、K之间的关系是K=$\frac{{K}_{2}}{{K}_{1}}$.
(3)某催化反应室中发生的反应为:
CH4(g)+H2O(g)═CO(g)+3H2(g)△H1=+216kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H2
已知CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-44kJ•mol-1,则△H2=+260 kJ•mol-1.
(4)某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如表:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂接触面积 有关.


 同),
同), SO2与SO3,下列说法正确的是
SO2与SO3,下列说法正确的是