题目内容
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:R>Y>X |
| B、气态氢化物的稳定性:R<W |
| C、WX3和水反应形成的化合物具有挥发性 |
| D、Z的单质能和Y的最高价氧化物的水化物反应 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素,X、W都有最低价-2,处于ⅥA,且W有最高价+6,故X为O、W为S;Y只有+1价,原子序数大于O,故Y为Na;Z只有+3价,结合原子序数可知Z为Al;R有+7、-1价,为Cl元素,结合元素化合物性质解答.
解答:
解:短周期元素,X、W都有最低价-2,处于ⅥA,且W有最高价+6,故X为O、W为S;Y只有+1价,原子序数大于O,故Y为Na;Z只有+3价,结合原子序数可知Z为Al;R有+7、-1价,为Cl元素,
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>S>O,故A错误;
B.R为Cl、W为S,非金属性S<Cl,故气态氢化物H2S<HCl,故B错误;
C.SO3和水反应形成的化合物为硫酸,是高沸点的酸,不具有挥发性,故C错误;
D.Al与氢氧化铝反应生成偏铝酸钠与氢气,故D正确,
故选D.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>S>O,故A错误;
B.R为Cl、W为S,非金属性S<Cl,故气态氢化物H2S<HCl,故B错误;
C.SO3和水反应形成的化合物为硫酸,是高沸点的酸,不具有挥发性,故C错误;
D.Al与氢氧化铝反应生成偏铝酸钠与氢气,故D正确,
故选D.
点评:本题考查结构性质位置关系,难度中等,根据化合价推断元素是解题的关键,注意基础知识的掌握.

练习册系列答案
相关题目
对于下列事实的解释错误的是( )
| A、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
| D、浓硝酸试剂瓶口常有白雾,说明浓硝酸有挥发性 |
下列递变规律正确的是( )
| A、KOH、Ca (OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
| B、Na、Mg、Al、Si的金属性逐渐增强 |
| C、HF、HCl、H2S、PH3的稳定性依次增强 |
| D、O、S、Na、K的原子半径依次增大 |
下列说法中正确的是( )
| A、第3周期所包含的元素中,钠的第一电离能最大 |
| B、最外层都只有一个电子的X、Y原子的性质完全相同 |
| C、KF是离子化合物、HF为共价化合物 |
| D、在同一周期中,随着原子序数的增大,元素的电负性越来越小 |
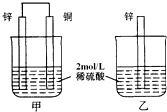 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |
下列说法正确的是( )
| A、氢氧化钠的摩尔质量是40g |
| B、“物质的量浓度”可简称为“量浓度” |
| C、阿伏加德罗常数的单位是mol-1 |
| D、1mol任何物质所占体积都是22.4 L |
萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②酒精 ③苯( )
| A、只有① | B、①和③ |
| C、①和② | D、①②③ |
下列离子方程式书写正确的是( )
| A、硫酸镁与氢氧化钾反应:MgSO4+2OH-=Mg(OH)2↓+SO42- |
| B、氧化铜与稀硫酸反应:O2-+2H+=H2O |
| C、碳酸钙与醋酸反应:CO32-+2H+=CO2↑+H2O |
| D、氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O |
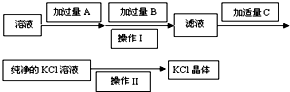 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作: