题目内容
19.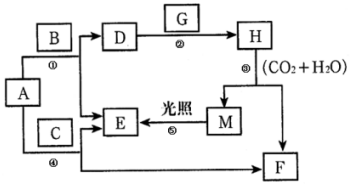 现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图,其他与题无关的生成物均已略去.请回答下列问题:
现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图,其他与题无关的生成物均已略去.请回答下列问题:(1)写出H、G的化学式:HNaClO,GCl2.
(2)写出①、⑤的化学方程式:
①2Na2O2+2H2O=4NaOH+O2↑,⑤2HClO$\frac{\underline{\;光照\;}}{\;}$HCl+O2↑.
(3)写出③的离子方程式2ClO-+H2O+CO2=2HClO+CO32-.
(4)写出F的水溶液与石灰水反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
分析 现有A、B、C、D、E、F、G、H、M九种物质,A为淡黄色粉末,则A为Na2O2,A能与C反应得到E与F,且C为气体,E为气体单质,可推知C为CO2,E为O2,F为Na2CO3,F的水溶液与澄清石灰水混合可制得D的溶液,则D为NaOH,而A与B反应得到D,故B为H2O,G为黄绿色气体单质,为Cl2,与氢氧化钠溶液反应得到H,H与二氧化碳、水反应得到M,M光照可以生成氧气,可推知M为HClO,H为NaClO,以此解答该题.
解答 解:(1)由上述分析可知,H为NaClO,G为Cl2,故答案为:NaClO; Cl2;
(2)①为过氧化钠和水的反应,方程式为2Na2O2+2H2O=4NaOH+O2↑,⑤为次氯酸的分解,方程式为2HClO$\frac{\underline{\;光照\;}}{\;}$HCl+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2HClO$\frac{\underline{\;光照\;}}{\;}$HCl+O2↑;
(3)③为NaClO与二氧化碳的反应,生成HClO,离子方程式为2ClO-+H2O+CO2=2HClO+CO32-,故答案为:2ClO-+H2O+CO2=2HClO+CO32-;
(4)F为Na2CO3,与石灰水反应生成碳酸钙沉淀,化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
点评 本题考查无机物推断,为高考常见题型,涉及Na、Cl元素单质化合物性质,“淡黄色粉末A与气体C反应得到气体单质E”是推断突破口,需要学生熟练注意元素化合物知识,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.原子序数依次增大的4种元素a、b、c、d,它们的原子核外L层电子数分别为5、6、8、8.c+的电子层结构与Ne的电子层结构相同,d-比c+多一个电子层.下列叙述正确的是( )
| A. | 元素的非金属性:c>b | |
| B. | a与b只能形成化合物ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | c与d形成的化合物能促进水的电离 |
7.下列有机反应属于取代反应的是( )
| A. | 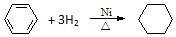 | |
| B. | CH2=CH2$\stackrel{催化剂}{→}$ 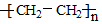 | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O |
11.下列实验操作、现象及由此得出的结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
| B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
| A. | A | B. | B | C. | C | D. | D |

 化学在能源开发与利用中起到十分关键的作用.甲醇是一种新型的绿色能源,又是一种重要的化工原料.甲醇燃料电池能量转化率高,具有广阔的发展前景.现用甲醇燃料电池进行如图实验.已知:2CH3OH+3O2+4OH-═2CO32-+6H2O
化学在能源开发与利用中起到十分关键的作用.甲醇是一种新型的绿色能源,又是一种重要的化工原料.甲醇燃料电池能量转化率高,具有广阔的发展前景.现用甲醇燃料电池进行如图实验.已知:2CH3OH+3O2+4OH-═2CO32-+6H2O