题目内容
1.常温下,向100mL 0.1mol/L NaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也为100mL,此时醋酸的电离常数为b,用含b的代数式表示原醋酸溶液的浓度a=$\frac{1{0}^{-8}}{b}+0.1$mol/L.分析 NaHCO3溶液中滴加amol/L的醋酸溶液,二者会反应生成醋酸钠、水、二氧化碳,当滴加到溶液呈中性时,所得溶液为醋酸和醋酸钠的混合液,根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于反应后的溶液呈中性,即c(H+)=c(OH-)=10-7mol/L,可知c(Na+)=c(CH3COO-)=$\frac{0.1×0.1}{0.2}$=0.05 mol/L,把c(H+)、c(CH3COO-)的数据代入醋酸的电离常数b=$\frac{c(CH3CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,结合物料守恒可得滴加的醋酸溶液的浓度a.
解答 解:常温下,向100mL 0.1mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,NaHCO3溶液中滴加amol/L的醋酸溶液,二者会反应生成醋酸钠、水、二氧化碳,当滴加到溶液呈中性时,所得溶液为醋酸和醋酸钠的混合液,根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于反应后的溶液呈中性,即c(H+)=c(OH-)=10-7mol/L,可知c(Na+)=c(CH3COO-)=$\frac{0.1×0.1}{0.2}$=0.05 mol/L,把c(H+)、c(CH3COO-)的数据代入醋酸的电离常数b=$\frac{c(CH3CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,则得反应后溶液中c(CH3COOH)=$\frac{5×1{0}^{-9}}{b}$mol/L,然后根据物料守恒可得滴加的醋酸溶液的浓度a=($\frac{5×1{0}^{-9}}{b}$+0.05)×2=$\frac{1{0}^{-8}}{b}+0.1$mol/L;
故答案为:$\frac{1{0}^{-8}}{b}+0.1$mol/L.
点评 本题考查了电离常数的计算、电荷守恒和物料守恒的应用,题目难度中等,侧重于考查学生的计算能力和分析能力,注意把握混合溶液的成分以及电荷守恒和物料守恒的应用方法.

| A. | 用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 | |
| B. | 用药匙或者纸槽把粉末状药品送入试管的底部 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
| A. | 一定量的碳酸氢钠溶液中加入足量澄清石灰水 HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 漂白粉的稀溶液中通入过量SO2气体 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | Ba(OH)2溶液加入过量NaHSO4溶液中:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| A. | 加入适量等浓度的NaOH溶液 | B. | 加入适量水 | ||
| C. | 通入适量H2S气体 | D. | 加入适量等浓度的NaHS溶液. |
| A. | 30 | B. | 44 | C. | 46 | D. | 80 |
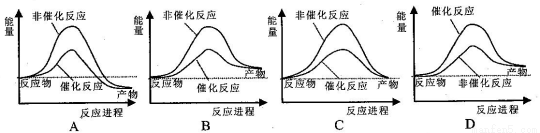
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g) CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
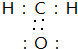
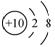 B. 次氯酸的结构式:H-Cl-O
B. 次氯酸的结构式:H-Cl-O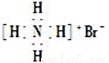 D. 质子数为53,中子数为78的碘原子:
D. 质子数为53,中子数为78的碘原子: