题目内容
16.14g 铁粉全部溶于某稀硝酸中,恰好反应,放出 NO 气体后得到溶液 1L.称量所得溶液,发现比原硝酸溶液增重 8g.则原溶液中硝酸的浓度为( )| A. | 0.4 mol/L | B. | 0.6 mol/L | C. | 0.8 mol/L | D. | 1.0 mol/L |
分析 进入溶液的是铁元素,产生的是NO气体,根据差量法可以计算一氧化氮的质量,金属和硝酸之间的反应分为铁过量和不足两种情况,可以根据一氧化氮的物质的量确定是哪种情况,根据电子守恒和元素守恒设未知数进行计算即可.
解答 解:铁与稀硝酸可能发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
由质量守恒可知m(NO)=14g-8g=6g,n(NO)=$\frac{6g}{30g/mol}$=0.2mol,
14g铁的物质的量为:n(Fe)=$\frac{14g}{56g/mol}$=0.25mol,
若生成Fe(NO3)3,则生成0.25molNO,
如生成Fe(NO3)2,则生成0.25mol×$\frac{2}{3}$=$\frac{0.5}{3}$molNO,
则说明反应后生成Fe(NO3)3和Fe(NO3)2的混合物,
设Fe(NO3)3和Fe(NO3)2物质的量分别为xmol、ymol,
根据Fe元素守恒及电子转移守恒可得:x+y=0.25,3x+2y=0.2×3,
解得x=0.1、y=0.15,
根据N元素守恒可知,n(HNO3)=3n[Fe(NO3)3]+2n[Fe(NO3)2]+n(NO)=3×0.1mol+2×0.15mol+0.2mol=0.8mol,
原硝酸的物质的量浓度为:$\frac{0.8mol}{1L}$=0.8 mol/L,
故选C.
点评 本题考查化学方程式的计算,题目难度中等,正确判断反应产物为解答关键,注意元素守恒和电子守恒的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.下列有关化学键的叙述,正确是的( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物一定不是共价化合 | |
| D. | 含有共价键的化合物一定是共价化合物 |
7.元素周期表是学习化学的重要工具,它隐含着周期表中所反映的许多信息和规律.下表所列是五种短周期的原子半径及主要化合价
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分).
(2)B元素处于周期表中三周期ⅢA族;
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(5)用电子式表示A、D形成化合物的过程 ;
;
(6)C、E形成化合物为SO2、SO3(填化学式).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(5)用电子式表示A、D形成化合物的过程
 ;
;(6)C、E形成化合物为SO2、SO3(填化学式).
11.下表为元素周期表的一部分用元素符号、离子符号或化学式回答下列问题.
(1)在上表所列出的短周期元素中,原子半径最小的是F(除稀有气体元素);形成的气态氢化物最稳定的是HF;最高价氧化物对应的水化物中酸性最强的是HClO4;简单阳离子半径最小的是Al3+.
(2)写出④与⑧元素组成的分子的电子式: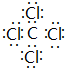 ,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为
,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为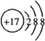 .
.
(3)②与⑧形成的化合物溶于水所克服的微粒间作用力为离子键.
(4)①②③几种元素最高价氧化物对应的水化物碱性最强的是KOH,元素①单质和⑥的氢化物反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)⑦⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 3 | ② | ③ | ⑧ | ⑩ | ||||
| 4 | ① | ⑨ |
(2)写出④与⑧元素组成的分子的电子式:
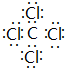 ,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为
,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为 .
.(3)②与⑧形成的化合物溶于水所克服的微粒间作用力为离子键.
(4)①②③几种元素最高价氧化物对应的水化物碱性最强的是KOH,元素①单质和⑥的氢化物反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)⑦⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-.
1.下列叙述正确的是( )
| A. | 化学反应一定只伴随热量的变化 | |
| B. | 凡是吸热或放热过程中热量的变化均称为反应热 | |
| C. | 若△H<0,则反应物的能量高于生成物的能量 | |
| D. | 若△H>0,则反应物的能量高于生成物的能量 |
5.下列各组物质中,互为同系物的是( )
| A. | CH2=CHCH2CH3和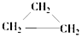 | B. |  和 和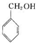 | ||
| C. | 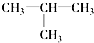 和CH3CH2CH2CH3 和CH3CH2CH2CH3 | D. | CH3CH2Cl与CH3CH2CH2Cl |
6.将一定质量的Al2O3固体投入100mL浓度为2mol/L的盐酸溶液中得到无色透明的澄清溶液,继续向所得溶液里加入物质的量浓度1mol/L的NaOH溶液,当沉淀达到最大时,加入NaOH溶液的体积是( )
| A. | 50 mL | B. | 100 mL | C. | 200 mL | D. | 300 mL |
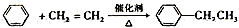

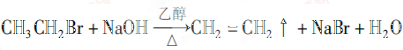 .
.