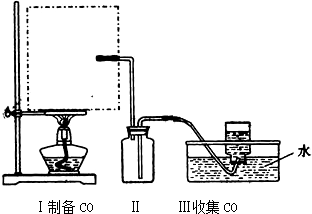
题目内容
9. 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O实验过程如下:在容积为100mL的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,
收集到粗产品,精制得到正丁醚.回答下列问题:
(1)合成粗产品时,液体试剂加入顺序是先加正丁醇,后加浓硫酸.
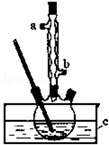
(2)实验中冷凝水应从a口出去(填“a”或“b”).
(3)为保证反应温度恒定在135℃,装置C中所盛液体必须具有的物理性质为该液体沸点大于135℃.
(4)加热时间过长或温度过高,反应混合液会变黑,写出用NaOH溶液吸收有毒尾气的离子方程式2OH-+SO2═SO32-+H2O.
(5)得到的正丁醚粗产品依次用8mL 50%的硫酸、10mL水萃取洗涤.该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、分液漏斗.该仪器使用前需要检验是否漏水.
(6)将分离出的有机层用无水氯化钙干燥,过滤后再进行蒸馏(填操作名称)精制得到正丁醚.
(7)本实验最终得到6.50g正丁醚,则正丁醚的产率是50.0%.
分析 在容积为100mL的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚,
(1)浓硫酸与其它液体混合时,先加其它液体后加硫酸;
(2)用冷凝管冷凝时,冷凝水的流向与气体流向相反;
(3)液体能达到的最高温度等于其沸点;
(4)浓硫酸被还原生成二氧化硫,用氢氧化钠溶液吸收二氧化硫;
(5)分离分层的液体用分液漏斗;带有玻璃塞的仪器使用前要检漏;
(6)有机物易挥发;
(7)产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)浓硫酸与其它液体混合时,先加其它液体后加硫酸,防止浓硫酸稀释时放热,引起液体飞溅,所以液体试剂加入顺序是先加正丁醇,后加浓硫酸,
故答案为:先加正丁醇,后加浓硫酸;
(2)用冷凝管冷凝时,冷凝水的流向与气体流向相反,则冷凝水从a口进入,
故答案为:a;
(3)加热液体能达到的最高温度等于其沸点,则为保证反应温度恒定在135℃,装置C中所盛液体的沸点应该大于135℃,
故答案为:该液体沸点大于135℃;
(4)加热时间过长或温度过高,反应混合液会变黑,浓硫酸与丁醇发生氧化还原反应,浓硫酸被还原生成二氧化硫,用氢氧化钠溶液吸收二氧化硫,其二氧化硫与氢氧化钠的反应离子方程式为:2OH-+SO2═SO32-+H2O;
故答案为:2OH-+SO2═SO32-+H2O;
(5)分离分层的液体用分液漏斗,该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、分液漏斗;带有玻璃塞的仪器使用前要检漏,则在使用分液漏斗时要先检验是否漏水;
故答案为:分液漏斗;检验是否漏水;
(6)将分离出的有机层用无水氯化钙干燥,正丁醚易挥发,采用蒸馏的方法获得纯净的正丁醚,
故答案为:蒸馏;
(7)由2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,
74×2 130
14.8g mg
则m=$\frac{14.8g×130}{74×2}$=13.0g
产率=$\frac{实际量}{理论量}$×100%=$\frac{6.5g}{13.0g}$×100%=50.0%,
故答案为:50.0%.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,题目难度中等,注意把握常见实验操作、尾气处理、仪器使用,注意对基础知识的理解掌握.

| A. | 2v正(B)=v逆(C) | B. | 该体系的密度都不随时间变化 | ||
| C. | 1molA断裂,同时1molC也断裂 | D. | 该体系的温度不随时间而变化 |
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间.
| 序号 | 反应温度/℃ | c(H2O2)/mol•L-1 | V(H2O2)/mL | m(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4(填序号)作对比.
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-═2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:①0.1mol•L-1 KI溶液 ②0.1mol•L-1 FeCl3溶液
③0.1mol•L-1 FeCl2溶液 ④0.1mol•L-1 盐酸
⑤0.1mol•L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂⑤(填序号),现象溶液显血红色,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2),c(NO2)随时间变化的数据记录如图所示.
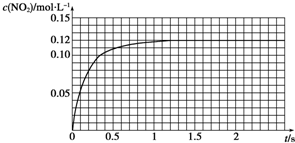
①反应容器中最后剩余的物质有N2O4和NO2,其中N2O4的物质的量为0.004mol.
②c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,从开始到平衡建立这段时间的平均反应速率为0.1mol/(L.s).
a.将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
b.向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
c.趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
d.待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
e.将制得的FeSO4•7H2O晶体放在一个小广口瓶中,密闭保存.请回答下列问题:
①实验步骤b明显不合理,理由是应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在.
②实验步骤d中用少量冰水洗涤晶体,其目的是洗涤除去晶体表面附着的硫酸等杂质,用冰水洗涤可降低洗涤过程中FeSO4•7H2O的损耗.
(2)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如表所示(仅在56.7℃、64℃温度下可同时析出两种晶体).
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
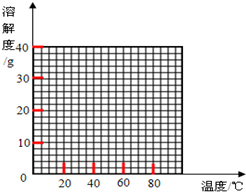
(3)若需从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度(t)的范围为56.7℃<t<64℃.
(4)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
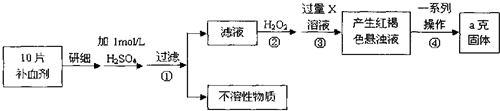
请回答下列问题:
①证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:氯水(或双氧水、稀硝酸);溶液由浅绿色变为血红色.
②步骤④中一系列处理的操作步骤:过滤、灼烧、称量.
③若实验无损耗,则每片补血剂含铁元素的质量0.07ag.
④该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素(Fe2+)含量的测定,请写出该反应的化学方程式10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O.
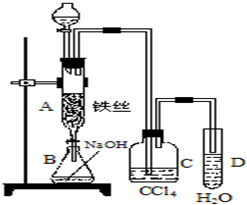 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.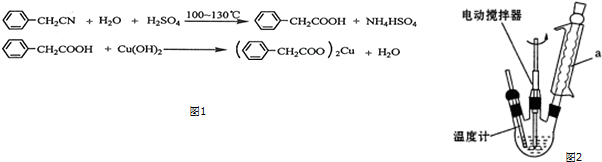
 N和Si是合成新型非金属材料的两种重要元素.请回答:
N和Si是合成新型非金属材料的两种重要元素.请回答: ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.
;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.