题目内容
3.用50吨含淀粉80%(质量分数)的粮食,可以制得多少千克葡萄糖?(假设葡萄糖的产率为85%)分析 根据淀粉质量分数计算淀粉质量,再根据关系式:(C6H10O5)n→nC6H12O6,计算制得葡萄糖的质量.
解答 解:淀粉的质量=50t×80%=40t=40000Kg
设实际可制得C6H12O6 质量为m Kg,则:
(C6H10O5)n→nC6H12O6
162n 180n
40000Kg m Kg÷85%
所以162n:180n=40000kg:(m Kg÷85%)
解得m=3.8×104,
答:可以制得3.8×104kg葡萄糖.
点评 本题考查化学方程式的计算,可以将葡萄糖的产率转化为淀粉的利用率计算,注意淀粉水解反应方程式,题目难度不大.

练习册系列答案
相关题目
13.如图装置能达到实验目的是( )
| A. |  检验产物中含有乙烯 | B. |  中和热的测定 | ||
| C. |  验证减压蒸馏原理 | D. |  验证碳酸的酸性强于苯酚 |
14.X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物 ZX;Y、M同主族,可形成 MY2、MY3两种分子.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
(6)由碳元素(C)、Y和 M三种元素组成的化合物 CYM中,所有原子的最外层满足 8电子结构.写出该化合物的电子式(电子式中 Y、M用元素符号表示)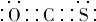 .
.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
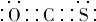 .
.
8.有一包粉末,可能是氯化钾、碳酸钠、三氯化铁、硫酸钠、硝酸钡中的一种或几种组成.为了研究它的组成,我做了如下实验,现将研究的问题和实验过程填写在下表中(假设各步恰好完全反应):
通过实验推断此粉末的组成是硫酸钠、碳酸钠、硝酸钡、氯化钾..
| 问题 | 实验步骤 | 实验现象 | 结论 | |
实验一 | 存在有色离子吗? | 取少量粉末,加水,溶解,过滤 | 有白色沉淀生成,滤液无色 | 这种粉末中一定无FeCl3 |
实验二 | 白色沉淀是什么? | 取少量沉淀,向其中滴加稀盐酸 | 沉淀部分溶解有气泡产生 | 有硫酸钠、碳酸钠、硝酸钡 |
实验三 | 是否含有KCl? | 取少量滤液,滴加硝酸银溶液和稀硝酸 | 产生白色沉淀 | 有KCl存在 |
9.C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列情况相符的是( )
| A. | 4个-CH3,能生成4种一氯取代物 | B. | 3个-CH3,能生成3种一氯取代物 | ||
| C. | 3个-CH3,能生成4种一氯取代物 | D. | 2个-CH3,能生成4种一氯取代物 |
10.下列有关物质性质或应用的说法不正确的是( )
| A. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| B. | 盐析可提纯蛋白质并保持其生理活性 | |
| C. | 从煤焦油中可分离出苯、甲苯及二甲苯 | |
| D. | 锂具有还原性、导电性和比能量高,可用作锂电池的负极材料 |
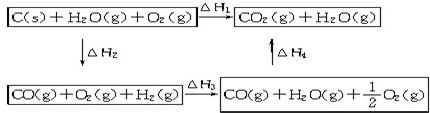
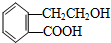 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 ;
;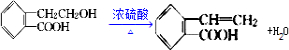 .
.