题目内容
1.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,2.24LSO2所含有的分子数小于0.1NA | |
| B. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 28.6gNa2CO3•10H2O溶于水配成1L溶液,该溶液中阴离子数目为0.1NA |
分析 A、常温常压下气体摩尔体积大于22.4L/mol;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、重水的摩尔质量为20g/mol;
D、碳酸根在溶液中水水解.
解答 解:A、常温常压下气体摩尔体积大于22.4L/mol,故2.24L二氧化硫的物质的量小于0.1mol,故分子个数小于0.1NA个,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于NA个,故B错误;
C、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,故含9NA个质子,故C错误;
D、28.6gNa2CO3•10H2O的物质的量为0.1mol,而溶于水后碳酸根在溶液中水水解,导致阴离子个数增多,故溶液中的阴离子的个数多于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
11.表中的数据表示破坏1mol化学键需要消耗的能量.计算1molH2(g)与O2(g)反应生成1molH2O(g)所释放的能量为245kJ.
| 化学键 | H-H | O-O | O═O | O-H |
| 能量(kJ) | 436 | 138 | 498 | 465 |
9.已知氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列有关叙述中不正确的是( )
①NH4H是离子化合物,含有离子键和共价键 ②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂 ④NH4H固体投入少量的水中,有两种气体生成.
①NH4H是离子化合物,含有离子键和共价键 ②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂 ④NH4H固体投入少量的水中,有两种气体生成.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
16.化学在生产、生活中有着重要用途,下列对物质的用途、解释都正确的是( )
| 选项 | 物质 | 用途 | 解释 |
| A | H2O2 | 消毒剂 | H2O2具有强氧化性,可杀菌 |
| B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
| C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
| D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法不正确的是( )
| A. | 溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小 | |
| B. | 硅单质广泛用于光纤通讯 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
13.配制100mL 1mol/L NaOH溶液必须的仪器是( )
| A. | 量筒 | B. | 试管 | C. | 容量瓶 | D. | 分液漏斗 |
11.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3).

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
表2原料价格表
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
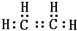 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH