题目内容
11.表中的数据表示破坏1mol化学键需要消耗的能量.计算1molH2(g)与O2(g)反应生成1molH2O(g)所释放的能量为245kJ.| 化学键 | H-H | O-O | O═O | O-H |
| 能量(kJ) | 436 | 138 | 498 | 465 |
分析 根据表中数据可知断裂1molH-H、1molO═O键分别吸收436kJ、498kJ的热量,形成1molO-H键放出465kJ热量,然后根据反应热等于反应物的总键能-生成物的总键计算出1molH2(g)与O2(g)反应生成1molH2O(g)所释放的能量.
解答 解:发生反应为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g),该反应的反应热△H=反应物总键能-生成物总键能=436kJ/mol+498kJ/mol×$\frac{1}{2}$-465kJ/mol×2=-245kJ/mol,
所以1molH2(g)与O2(g)反应生成1molH2O(g)所释放的能量为:245kJ/mol×1mol=245kJ,
故答案为:245.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确热化学方程式中反应热与反应物、生成物总键能的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
8.以下是初中化学中的一些基本经验,不能达到实验目的是( )
| A. |  制取氧气 | B. |  稀释浓硫酸 | ||
| C. |  检查装置气密性 | D. |  粗盐过滤 |
9.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | K+、NH4+、OH-、SO42- |
6.0.16g氢氧化钠恰好与20mL盐酸完全反应,则盐酸的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 0.2mol•L-1 | C. | 0.5mol•L-1 | D. | 1mol•L-1 |
6.下列物质间的反应,其能量变化符合如图的是( )
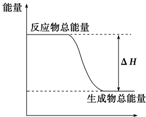

| A. | 铝热反应 | B. | 灼热的炭与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1L mol•L-1CH3COOH溶液中含有0.1NA个H+ | |
| C. | 标准状况下的22.4L辛烷完全燃烧,生成CO2分子数为8NA | |
| D. | 1mol 乙炔中含有的电子数为12NA |
1.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,2.24LSO2所含有的分子数小于0.1NA | |
| B. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 28.6gNa2CO3•10H2O溶于水配成1L溶液,该溶液中阴离子数目为0.1NA |

 ,在B分子中Y原子的杂化方式为sp3,B中O-Y-H的键角小于(填“大于”“等于”或“小于”)A中O-Y-H键角.
,在B分子中Y原子的杂化方式为sp3,B中O-Y-H的键角小于(填“大于”“等于”或“小于”)A中O-Y-H键角.