题目内容
11.只含非金属元素的晶体描述正确的是( )| A. | 有可能是金属晶体 | B. | 有可能是离子晶体 | ||
| C. | 一定是分子晶体 | D. | 一定不是原子晶体 |
分析 只含非金属元素的晶体可能为分子晶体,例如H2O,也可能为离子晶体,例如NH4Cl,还可能为原子晶体,例如SiO2,据此分析.
解答 解:只含非金属元素的晶体可能为分子晶体,例如H2O,也可能为离子晶体,例如NH4Cl,还可能为原子晶体,例如SiO2,不可能为金属晶体,所以B正确,ACD错误,
故选:B.
点评 本题考查晶体类型的判断,注意利用实例分析,题目难度不大.

练习册系列答案
相关题目
12.如果1g水中含有a个氢原子,则阿伏加德罗常数是( )
| A. | $\frac{1}{9a}$ mol-1 | B. | 9a mol-1 | C. | 2a mol-1 | D. | 18a mol-1 |
16.某厂平均每天产生约600m3废氨水(NH3 的浓度为153mg•L-1,密度为1g•cm-3.
(1)该废氨水中氨的物质的量浓度为9×10-3 mol•L-1.
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17mg•L-1.忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为4800mol.(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO.4NH3+5O2→4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80.
①为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为89%.
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O.将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1:10,试求参加主反应的氨占原料氨的体积百分含量.
(4)废氨水可用于脱除烟气中的SO2.氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物.现称取不同质量的混合物进行实验,结果如下:
试计算生成氨气的质量最大时样品的质量.
(1)该废氨水中氨的物质的量浓度为9×10-3 mol•L-1.
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17mg•L-1.忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为4800mol.(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO.4NH3+5O2→4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80.
①为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为89%.
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O.将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1:10,试求参加主反应的氨占原料氨的体积百分含量.
(4)废氨水可用于脱除烟气中的SO2.氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物.现称取不同质量的混合物进行实验,结果如下:
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
20.该物质最多有几个碳原子共面( )


| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
1.下列属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Cl2+H2O═HCl+HClO | ||
| C. | H2SO4+Na2SO3=Na2SO4+SO2↑+H2O | D. | FeS+2HCl═FeCl2+H2S↑ |
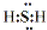 ;
;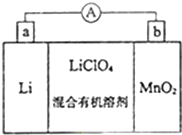 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题: