题目内容
如图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应①②均为工业上的重要反应.
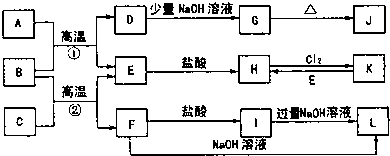
请回答下列问题:(1)工业冶炼C的化学方程式是 .
(2)在少量H溶液中加入NaOH溶液时的现象是 .
(3)在G、I、J、K的水溶液中,呈酸性的是 (填字母编号,下同);在B、D、F中,属于两性氧化物的是 .
(4)写出D与J的稀溶液反应生成G的化学方程式: .
(5)写出L溶液中通入过量D时发生反应的离子方程式: .
(6)写出在溶液K中通入SO2气体时发生反应的离子方程式: .

请回答下列问题:(1)工业冶炼C的化学方程式是
(2)在少量H溶液中加入NaOH溶液时的现象是
(3)在G、I、J、K的水溶液中,呈酸性的是
(4)写出D与J的稀溶液反应生成G的化学方程式:
(5)写出L溶液中通入过量D时发生反应的离子方程式:
(6)写出在溶液K中通入SO2气体时发生反应的离子方程式:
考点:无机物的推断
专题:推断题
分析:B为红棕色粉末,应为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe;顺推可知G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,F应为Al2O3,则C是Al,I为AlCl3,L为NaAlO2,结合物质的性质解答该题.
解答:
解:B为红棕色粉末,应为Fe2O3,A为无色有毒气体,结合转化关系,可推知A具有还原性,故A为CO,则D为CO2,E为Fe;顺推可知G为NaHCO3,J为Na2CO3,H是FeCl2,K为FeCl3,金属C与氧化铁反应生成Fe与F,F为金属氧化物,既与盐酸反应又能与氢氧化钠反应,F应为Al2O3,则C是Al,I为AlCl3,L为NaAlO2,
(1)工业上,电解熔融飞氧化铝冶炼Al,化学方程式为2Al2O3
4A1+3O2↑,
故答案为:2Al2O3
4A1+3O2↑;
(2)氯化亚铁溶液中加入NaOH溶液,首先析出白色絮状沉淀,迅速变为灰绿色,最后变为红褐色,
故答案为:白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;
(3)G为NaHCO3,I为AlCl3,J为Na2CO3,K为FeCl3,碳酸钠、碳酸氢钠溶液中阴离子水解,溶液呈碱性,氯化铝、氯化铁溶液中金属阳离子水解,溶液呈酸性,
B为Fe2O3,D为CO2,F为Al2O3,属于两性氧化物的是氧化铝,
故答案为:I、K;F;
(4)D为CO2,J为Na2CO3,二者反应生成NaHCO3,反应方程式为CO2+Na2CO3+H2O=2NaHCO3,
故答案为:CO2+Na2CO3+H2O=2NaHCO3;
(5)NaAlO2溶液中通入过量CO2,反应生成氢氧化铝沉淀与碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(6)在溶液FeCl3中通入SO2气体,氯化铁具有强氧化性,将二氧化硫氧化为硫酸根,反应离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+.
(1)工业上,电解熔融飞氧化铝冶炼Al,化学方程式为2Al2O3
| ||
| 冰晶石 |
故答案为:2Al2O3
| ||
| 冰晶石 |
(2)氯化亚铁溶液中加入NaOH溶液,首先析出白色絮状沉淀,迅速变为灰绿色,最后变为红褐色,
故答案为:白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;
(3)G为NaHCO3,I为AlCl3,J为Na2CO3,K为FeCl3,碳酸钠、碳酸氢钠溶液中阴离子水解,溶液呈碱性,氯化铝、氯化铁溶液中金属阳离子水解,溶液呈酸性,
B为Fe2O3,D为CO2,F为Al2O3,属于两性氧化物的是氧化铝,
故答案为:I、K;F;
(4)D为CO2,J为Na2CO3,二者反应生成NaHCO3,反应方程式为CO2+Na2CO3+H2O=2NaHCO3,
故答案为:CO2+Na2CO3+H2O=2NaHCO3;
(5)NaAlO2溶液中通入过量CO2,反应生成氢氧化铝沉淀与碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(6)在溶液FeCl3中通入SO2气体,氯化铁具有强氧化性,将二氧化硫氧化为硫酸根,反应离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+.
点评:本题考查无机物的推断,题目难度中等,以A、B为突破口进行推断,侧重考查元素化合物性质,学习中注意把握.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 右图为摇摆电池(Rockingchair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C
右图为摇摆电池(Rockingchair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C| 充电 |
| 放电 |
| A、放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+xLi+ |
| B、充电时,A极发生氧化反应 |
| C、充电时,Li+穿过隔离膜向B极移动 |
| D、当B极失去Xmol电子,电池消耗6 mol C |
有关如图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,不正确的是( )


| A、铜片上有红色物质附着 |
| B、取出盐桥后,电流计依然发生偏转 |
| C、反应中,盐桥中的K+会移向CuSO4溶液 |
| D、锌片上发生氧化反应 |
下列物质不属于空气污染物的是( )
| A、SO2 |
| B、CO2 |
| C、NO2 |
| D、NO |


 I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.
I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.