题目内容
12.有M、N两溶液,各含下列12种离子中的6种:Al3+、Na+、K+、SO42-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、H+,已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则下列说法正确的是( )| A. | N溶液无颜色 | |
| B. | M溶液里的两种阳离子为Na+和NH4+ | |
| C. | N溶液滴入BaCl2溶液无明显现象 | |
| D. | M溶液中通入足量CO2有白色沉淀生成 |
分析 两溶液所含离子各不相同,M溶液里的阳离子只有两种,由H+、Fe3+、NH4+、Al3+均能与OH-反应,则M中的阳离子为K+、Na+,N中的阳离子为H+、Fe3+、Al3+,则与N中阳离子反应的阴离子应在M中,剩余的阴离子在N中,以此来解答.
解答 解:由溶液中离子之间的反应可知,H+、Fe3+、NH4+、Al3+与OH-反应,不能大量共存,且M溶液里的阳离子只有两种,所以H+、Fe3+、NH4+、Al3+在N溶液中,K+、Na+、OH-在M溶液中,由此知,M溶液呈碱性,N溶液呈酸性;
N溶液呈酸性,能和酸反应的离子AlO2-、CO32-、S2-不能在N溶液中,只能在M溶液中,
高锰酸根离子有强氧化性,不能和S2-共存,所以MnO4-存在于N溶液中,
M溶液里的阳离子至少有两种,则Na+、K+在M溶液中,
由以上分析知,M溶液中存在的离子为:S2-、Na+、K+、OH-、CO32-、AlO2-;
N溶液中存在的离子为H+、Fe3+、NH4+、Al3+、MnO4-、SO42-,
A.N溶液中含有MnO4-,所以N溶液为有色溶液,故A错误;
B.M中含有的阳离子为Na+、K+,故B错误;
C.N溶液中含有SO42-,滴入氯化钡溶液后会生成硫酸钡沉淀,故C错误;
D.M溶液中含有AlO2-,通入二氧化碳后会生成氢氧化铝沉淀,故D正确;
故选D.
点评 本题考查了离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意掌握离子共存条件,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.在某溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42-和Ag+ | D. | 可能含有SO42-或Ag+ |
7.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:2Ba2++40H-+2S042-+Al3+=2BaS04↓+2H20+Al02- | |
| B. | 向NaHS04溶液中滴Ba(OH)2溶液至S042-完全沉淀:2 H++S042-+Ba2++20H-=BaS04↓+2H20 | |
| C. | 向0.1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:HA-十OH-=A2-+H20 | |
| D. | 向1L lmol.L-1的FeBr2溶液中通等物质的量Cl2:2Cl2+2Fe2++2Br-=4Cl-十2Fe3++Br2 |
4.下列实验中,有关仪器的下端必须插入液面以下的是( )
①制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管
②制备氯气装置中的分液漏斗
③制备氨水时将氨气溶于水的导管
④制备氢气的简易装置中加入稀硫酸用的长颈漏斗
⑤分馏石油时的温度计.
①制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管
②制备氯气装置中的分液漏斗
③制备氨水时将氨气溶于水的导管
④制备氢气的简易装置中加入稀硫酸用的长颈漏斗
⑤分馏石油时的温度计.
| A. | ①②④ | B. | ④ | C. | ①②③ | D. | ②③④ |
2.下表中是各组反应的反应物和温度,反应刚开始时,放出氢气速率最快的是( )
| 编号 | 金属(粉末状)mol | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 6mol/L硝酸10ml | 80 |
| B | Mg,0.1 | 3mol/L盐酸10ml | 60 |
| C | Fe,0.1 | 3mol/L盐酸10ml | 60 |
| D | Mg,0.1 | 3mol/L硫酸10ml | 60 |
| A. | A | B. | B | C. | C | D. | D |
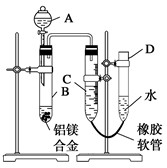 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.