题目内容
11.下列化合物中属于配合物的是( )①CuSO4•5H2O ②K2PtCl6 ③KCl•CuCl2 ④Cu(NH2CH2COO)2 ⑤KCl•MgCl2•6H2O ⑥Cu(CH3COO)2 .
| A. | ①③④⑥ | B. | ②③⑤ | C. | ①②④ | D. | ①③⑤ |
分析 配位化合物一般指由金属的原子或离子与含有孤对电子的分子或离子通过配位键结合形成的化合物.配离子或配合物可以在溶液中稳定存在.
解答 解:①CuSO4•5H2O实际组成为[Cu(H2O)4]SO4•H2O,含有[Cu(H2O)4]2+配离子,属于配合物;
②K2PtCl6 中存在配离子[PtCl6]2-,属于配合物;
③KCl•CuCl2在溶液中完全电离为钾离子、铜离子与离子,属于复盐,不属于配合物;
④Cu(NH2CH2COO)2 中N原子含有的孤对电子能与铜离子形成配位键,属于配合物;
⑤KCl•MgCl2•6H2O 属于复盐;
⑥Cu(CH3COO)2 为醋酸铜,溶于水电离出醋酸根,属于简单盐.
故选C.
点评 本题考查配合物概念,属易错题目,识记常见配合物,注意含有配位键的化合物就不一定是配位化合物,配离子或配合物可以在溶液中稳定存在.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
1.将盛有12mL NO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
| A. | 4mL | B. | 10.8mL | C. | 1.2mL或4mL | D. | 8mL或10.8mL |
6.第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.
(1)下列叙述正确的是AD.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
Mn原子价电子排布式为3d54s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于d区.Ti的一种氧化物X,其晶胞结构如图1所示,则X的化学式为TiO2.
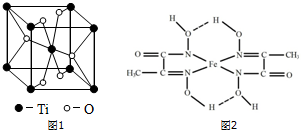
(4)某铁的化合物结构简式如图2所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为O>N>C>H (用元素符号表示)
②在图2中用“→”标出亚铁离子的配位键.
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为6,这几个O2-构成的空间构型为正八面体.已知Ni2+与O2-的核间距为anm,NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为$\frac{M×1{0}^{21}}{2{a}^{3}{N}_{A}}$ g/cm3.
(1)下列叙述正确的是AD.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于d区.Ti的一种氧化物X,其晶胞结构如图1所示,则X的化学式为TiO2.

(4)某铁的化合物结构简式如图2所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为O>N>C>H (用元素符号表示)
②在图2中用“→”标出亚铁离子的配位键.
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为6,这几个O2-构成的空间构型为正八面体.已知Ni2+与O2-的核间距为anm,NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为$\frac{M×1{0}^{21}}{2{a}^{3}{N}_{A}}$ g/cm3.
8.已知甲醛(CH2O)分子中的四个原子是共平面的.下列分子中所有原子不可能在同一平面上的是( )
| A. | 苯乙烯(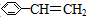 ) ) | B. | 苯甲酸(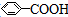 ) ) | C. | 苯甲醛(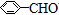 ) ) | D. | 苯乙酮(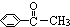 ) ) |
5.下列溶液不能用玻璃试剂瓶保存的是( )
| A. | 稀硫酸 | B. | NaOH | C. | 氢氟酸 | D. | 浓盐酸 |
 铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图;已知CN-与N2结构相似,1molCN-中π键数目为2NA.
铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图;已知CN-与N2结构相似,1molCN-中π键数目为2NA.


 .
.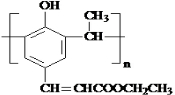 .
. +
+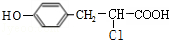 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.