题目内容
15.下列离子方程式正确的是( )| A. | 向硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 少量双氧水滴入酸性KI溶液:2H2O2+2I-+4H+═4H2O+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e-═2MnOOH+2OH- |
分析 A.氢氧化铝不溶于弱碱氨水;
B.二者反应生成碘和水,转移电子不守恒;
C.二者反应生成硝酸铁、NO和水,磁性氧化铁为四氧化三铁,应该写化学式;
D.正极上二氧化锰得电子生成MnOOH和OH-.
解答 解:A.氢氧化铝不溶于弱碱氨水,离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.二者反应生成碘和水,转移电子不守恒,离子方程式为H2O2+2I-+2H+═2H2O+I2,故B错误;
C.二者反应生成硝酸铁、NO和水,磁性氧化铁为四氧化三铁,应该写化学式,离子方程式为3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故C错误;
D.正极上二氧化锰得电子生成MnOOH和OH-,离子方程式为2MnO2+2H2O+2e-═2MnOOH+2 OH-,故D正确;
故选D.
点评 本题考查离子方程式正误判断,为高频考点,侧重考查学生分析判断能力,明确元素化合物性质、物质之间的转化及离子方程式书写规则是解本题关键,注意C中不仅仅是碱性氧化物和水的反应还发生氧化还原反应,为易错点.

练习册系列答案
相关题目
5.每克蛋白质完全氧化约放出18kJ的能量,每克葡萄糖完全氧化约放出17.2kJ的能量,每克油脂完全氧化约放出39.3kJ的能量.维生素基本不提供能量,但对身体健康有重要作用.现代部分青少年患有“营养过剩症”(肥胖),最不适宜他们多吃的食品是( )
| A. | 蛋白质含量高食品 | B. | 葡萄糖含量高食品 | ||
| C. | 油脂含量高食品 | D. | 维生素含量高食品 |
6. 图中的曲线表示的是其他条件一定时,反应:2NO+O2?2NO2△H<0中N0的平衡转化率与温度的关系.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
图中的曲线表示的是其他条件一定时,反应:2NO+O2?2NO2△H<0中N0的平衡转化率与温度的关系.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
 图中的曲线表示的是其他条件一定时,反应:2NO+O2?2NO2△H<0中N0的平衡转化率与温度的关系.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
图中的曲线表示的是其他条件一定时,反应:2NO+O2?2NO2△H<0中N0的平衡转化率与温度的关系.图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
3.已知化学反应:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1<0,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0,
C(s)+O2(g)═CO2(g)△H3<0;下列说法正确的是( )
C(s)+O2(g)═CO2(g)△H3<0;下列说法正确的是( )
| A. | 56 g CO和32 g O2所具有的总能量小于88 g CO2所具有的总能量 | |
| B. | 碳的燃烧热是△H3 | |
| C. | △H1<△H3 | |
| D. | 28 g CO的总能量比44 g CO2的总能量高 |
20.构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,以下能量大小顺序中正确的是( )
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)<E(4s)<E(3d) | D. | E(5s)>E(4s)>E(4f) |
7.下列有关实验的叙述正确的是( )
| A. | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 光照氯水有气泡冒出,该气体为Cl2 | |
| D. |  实验室可用如图所示装置制取饱和氨水 |

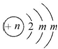
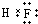 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.