题目内容
4.粗铜中含有锌、铁、镍、银、金等金属杂质,在精炼铜的过程中,杂质金属为什么不在阴极析出?精炼铜的过程中溶液中Cu2+的浓度是否有变化?分析 电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应首先为:Zn-2e-=Zn2+,Fe-2e-=Fe2+,后发生Cu-2e-=Cu2+,阴极材料是纯铜,电解质溶液为硫酸铜溶液,反应式一直为:Cu2++2e-=Cu,据此分析.
解答 解:电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应首先为:Zn-2e-=Zn2+,Fe-2e-=Fe2+,后发生Cu-2e-=Cu2+,阴极材料是纯铜,反应式一直为:Cu2++2e-=Cu,因为电解质溶液为硫酸铜溶液,溶液中铜离子得电子能力大于二价锌离子和二价铁离子,所以杂质金属不在阴极析出,精炼铜的过程中溶液中Cu2+的浓度将减小,答:电解质溶液为硫酸铜溶液,溶液中铜离子得电子能力大于二价锌离子和二价铁离子,所以杂质金属不在阴极析出,精炼铜的过程中溶液中Cu2+的浓度将减小.
点评 本题考查学生电解池的工作原理知识,注意精炼粗铜的装置以及反应过程,难度不大.

练习册系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 向硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 少量双氧水滴入酸性KI溶液:2H2O2+2I-+4H+═4H2O+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e-═2MnOOH+2OH- |
12.有关化学反应的说法中,正确的是( )
| A. | 自发反应都是放热反应 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 焓变大于0而熵变小于0的反应肯定自发 |
19.下列离子方程式中,正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2O | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
9.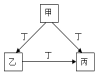 甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )
甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )
 甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )
甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )| A. | Al(OH)3 | B. | FeCl3 | C. | CO | D. | Na2CO3 |
16.生活中常见的荧光棒的发光原理可用下式表示: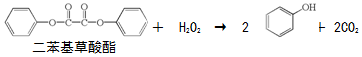
上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光.下列说法正确的是( )
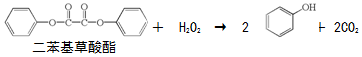
上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光.下列说法正确的是( )
| A. | 上述反应是酯的水解反应 | |
| B. | 荧光棒发光过程涉及化学能到光能的转化 | |
| C. | 二苯基草酸酯苯环上的一氯代物共有4种 | |
| D. | 二苯基草酸酯与草酸( 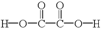 )互为同系物 )互为同系物 |
2.科学家最近发现一种不需外能源,可以除去废水中卤代烃(卤代烃危害人类健康)的方法,即把铁粉放在废水中,一段时间后,卤代烃“消失”,有人提出该过程的机理为:Fe+RCH2X+H+-→RCH3+X-+Fe2+(X为卤素).下列说法中正确的是( )
| A. | 若卤代烃的分子式为C4H9X,则RCH2X有5种结构 | |
| B. | 该反应是置换反应 | |
| C. | 反应过程中RCH2X是氧化剂 | |
| D. | 处理含1 mol卤代烃的废水时,转移4 mol电子 |
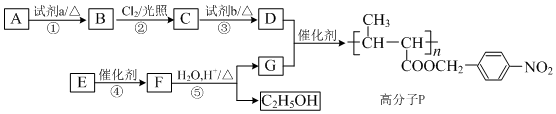
 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$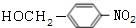 +NaCl.
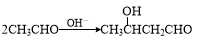
+NaCl.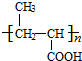 .
.
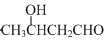 .
.