题目内容
实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体.某学生设计了如下方案.请回答下列问题.

①操作①可选择 仪器.
②加入试剂2的目的 ,此时发生反应的离子方程式: .
③常温下,将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,得到密度为1.17g/cm3的混合溶液.在1000g水中需加入 mol氯化钠,才能使其浓度恰好与上述混合溶液浓度相等.(保留1位小数)

①操作①可选择
②加入试剂2的目的
③常温下,将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,得到密度为1.17g/cm3的混合溶液.在1000g水中需加入
考点:粗盐提纯
专题:实验题
分析:①加热分解固体的仪器为坩埚.
②在NaCl溶液中除去SO42-离子要用到过量试剂1即BaCl2,除去过量的Ba2+需要用到过量的盐酸,此时发生反应的离子方程式:Ba2++CO32-=BaCO3↓.
③混合溶液中NaCl总质量为20.0g×14%+30.0g×24%=10g,水的总质量为(20g+30g)-10g=40g.如要使浓度相等,则1000g水中的NaCl质量为
=250g,物质的量为
≈4.3mol.
②在NaCl溶液中除去SO42-离子要用到过量试剂1即BaCl2,除去过量的Ba2+需要用到过量的盐酸,此时发生反应的离子方程式:Ba2++CO32-=BaCO3↓.
③混合溶液中NaCl总质量为20.0g×14%+30.0g×24%=10g,水的总质量为(20g+30g)-10g=40g.如要使浓度相等,则1000g水中的NaCl质量为
| 1000g×10g |
| 40g |
| 250g |
| 58.5g/mol |
解答:
解:①加热分解固体的仪器为坩埚,故答案为:坩埚;
②除杂时加入的试剂要过量,除SO42-离子是要用过量的BaCl2,所以加入试剂2的目的是:除去Ba2+;而除去过量的Ba2+需要用到过量的盐酸,所以此时发生反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:除去Ba2+;Ba2++CO32-=BaCO3↓;
③混合溶液中NaCl总质量为20.0g×14%+30.0g×24%=10g,水的总质量为(20g+30g)-10g=40g.如要使浓度相等,则1000g水中的NaCl质量为
=250g,物质的量为
≈4.3mol,即需要加入的氯化钠为:4.3mol,
故答案为:4.3.
②除杂时加入的试剂要过量,除SO42-离子是要用过量的BaCl2,所以加入试剂2的目的是:除去Ba2+;而除去过量的Ba2+需要用到过量的盐酸,所以此时发生反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:除去Ba2+;Ba2++CO32-=BaCO3↓;
③混合溶液中NaCl总质量为20.0g×14%+30.0g×24%=10g,水的总质量为(20g+30g)-10g=40g.如要使浓度相等,则1000g水中的NaCl质量为
| 1000g×10g |
| 40g |
| 250g |
| 58.5g/mol |
故答案为:4.3.
点评:本题为实验的基本操作和简单计算问题,综合性较强,在计算时注意带单位运算,防止出错,有利于学生计算能力、实验综合能力的培养.

练习册系列答案
相关题目
室温下,将1mol的CuSO4?5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2:CuSO4?5H2O受热分解的化学方程式为CuSO4?5H2O(s)
CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
| ||
| A、△H2>△H3 |
| B、△H1<△H3 |
| C、△H1+△H3=△H2 |
| D、△H1+△H2>△H3 |
常温下,下列指定条件下能大量共存的微粒是( )
| A、乙醇稀溶液:K+、Na+、SO42-、OH- | ||
| B、氨水溶液:Mg2+、Ag+、NO3-、CH3COOH | ||
C、
| ||
| D、使石蕊变红的溶液:Fe2+、Al3+、ClO-、CO32- |
元素周期律揭示元素间的递变规律,既有相似性又有递变性,下列递变规律正确的是( )
| A、第二周期元素氢化物稳定性的顺序是:HF>H2O,所以第三周期元素氢化物稳定性的顺序也是:HCl>H2S |
| B、IVA族元素氢化物熔点顺序是:SiH4>CH4,所以VA族元素氢化物熔点顺序也是:PH3>NH3 |
| C、ⅦA族元素的非金属性是:F>Cl,所以ⅦA族元素氢化物的酸性也是:HF>HCl |
| D、镁比铝活泼,工业上用电解熔融氧化铝制备铝,所以工业上也用电解熔融氧化镁制备镁 |
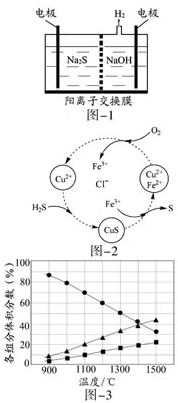 硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.
硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.
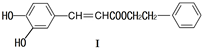

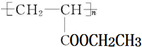 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为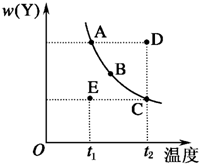 对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).