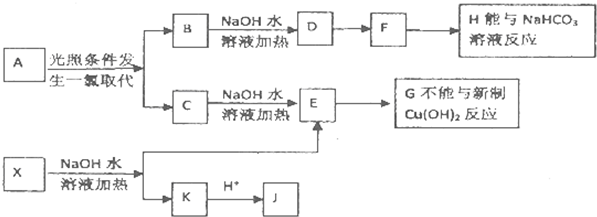
题目内容
 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题:【实验一】用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成.
(1)该反应的化学方程式为
(2)水槽中盛放的液体最好是
【实验二】用排水法收集一试管甲烷和氯气的混合气体,光照后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成.
(3)该实验结论不合理的原因是
【实验三】
步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同).测得pH=3.26.
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入10mL蒸馏水,充分振荡,测得pH=1.00.
(4)有同学认为:根据步骤二测得pH比步骤一测得pH要低,可以判断该反应中有氯化氢生成.你认为他的理由是否合理
(5)假设氯气完全参与反应,且不考虑氯气溶解于水.往反应后的溶液中加水稀释到100.00mL,取20.00mL稀释液,加入10.00mL浓度为0.01mol?L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为
考点:性质实验方案的设计,甲烷的取代反应
专题:
分析:(1)甲烷和氯气发生反应,甲烷分子中的氢原子被氯离子取代;
(2)氯气能和水反应生成盐酸和次氯酸,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水;
(3)根据氯水的成分进行解答;
(4)如果步骤二中没有生成HCl,那么pH也应该是3.26,现在pH变小,说明生成的HCl溶于水导致pH变小;
(5)根据甲烷和氯气反应的原理,每1mol氯气参加反应生成1mol氯化氢,据此分析解答.
(2)氯气能和水反应生成盐酸和次氯酸,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水;
(3)根据氯水的成分进行解答;
(4)如果步骤二中没有生成HCl,那么pH也应该是3.26,现在pH变小,说明生成的HCl溶于水导致pH变小;
(5)根据甲烷和氯气反应的原理,每1mol氯气参加反应生成1mol氯化氢,据此分析解答.
解答:
解:(1)甲烷与氯气在光照下发生取代反应,甲烷分子中的氢原子被氯气分子中的氯原子取代,生成一氯甲烷和氯化氢,
故答案为:CH4+Cl2
CH3Cl+HCl;
(2)Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水,
故答案为:饱和食盐水;
(3)氯水中存在化学平衡:Cl2+H2O?H++Cl-+HClO;次氯酸是弱电解质,溶液中存在三种分子:Cl2、HClO、H2O;四种离子:H+、Cl-、ClO-、OH-(少量),所以当氯水中加入AgNO3溶液时会发生Ag++Cl-=AgCl↓产生白色沉淀,
故答案为:氯水中加入AgNO3溶液也会产生白色沉淀;
(4)步骤一:氯气溶于水后,Cl2+H2O?H++Cl-+HClO也生成盐酸,其pH为3.26,步骤二:pH=1.00,比3.26小,说明除了氯气溶于水生成盐酸外还有别的反应产生HCl,
故答案为:不合理;
(5)取20.00mL稀释液,加入10.00mL浓度为0.01mol?L-1的AgNO3溶液恰好完全反应,参加反应的银离子的物质的量为1×10-4mol,根据方程式 Ag++Cl-=AgCl↓则100.00mL溶液中含氯离子5×10-4mol,根据甲烷和氯气反应的原理,每1mol氯气参加反应生成1mol氯化氢,则试管中原有氯气为5×10-4mol,在标准状况下的体积为5×10-4mol×22.4L/mol═1.12×10-2L=11.2mL,故答案为:11.2.
故答案为:CH4+Cl2
| 光照 |
(2)Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水,
故答案为:饱和食盐水;
(3)氯水中存在化学平衡:Cl2+H2O?H++Cl-+HClO;次氯酸是弱电解质,溶液中存在三种分子:Cl2、HClO、H2O;四种离子:H+、Cl-、ClO-、OH-(少量),所以当氯水中加入AgNO3溶液时会发生Ag++Cl-=AgCl↓产生白色沉淀,
故答案为:氯水中加入AgNO3溶液也会产生白色沉淀;
(4)步骤一:氯气溶于水后,Cl2+H2O?H++Cl-+HClO也生成盐酸,其pH为3.26,步骤二:pH=1.00,比3.26小,说明除了氯气溶于水生成盐酸外还有别的反应产生HCl,
故答案为:不合理;
(5)取20.00mL稀释液,加入10.00mL浓度为0.01mol?L-1的AgNO3溶液恰好完全反应,参加反应的银离子的物质的量为1×10-4mol,根据方程式 Ag++Cl-=AgCl↓则100.00mL溶液中含氯离子5×10-4mol,根据甲烷和氯气反应的原理,每1mol氯气参加反应生成1mol氯化氢,则试管中原有氯气为5×10-4mol,在标准状况下的体积为5×10-4mol×22.4L/mol═1.12×10-2L=11.2mL,故答案为:11.2.
点评:本题主要考查了甲烷的取代反应、氯气和水反应,掌握甲烷的化学性质是解答本题的关键,题目难度中等.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列离子方程式中错误的是( )
| A、Ba(OH)2溶液中滴加足量硫酸溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、氢氧化钡溶液中滴加少量硫酸溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钡溶液中滴加足量NaHSO4溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、氢氧化钡溶液中滴加少量NaHSO4溶液:Ba2++OH-+H++SO42-=BaSO4↓+2H2O |
据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He的形式存在.下列说法正确的是( )
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
丙烯醇(CH2=CH-CH2OH)可发生的化学反应( )
①加成 ②氧化 ③加聚 ④取代 ⑤置换.
①加成 ②氧化 ③加聚 ④取代 ⑤置换.
| A、①②③ | B、①②④ |
| C、①②③④ | D、①②③④⑤ |
在一定温度下,向容积固定不变的密闭容器里充入a mol N2O4发生如下反应:N2O4 (气)?2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是( )
| A、平均相对分子质量增大 |
| B、N2O4的转化率提高 |
| C、压强为原来的2倍 |
| D、颜色变深 |
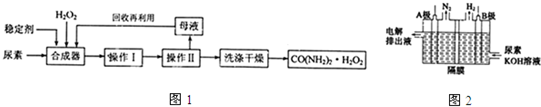
 MnO4-+
MnO4-+ H2O2+
H2O2+ =
= Mn2++
Mn2++ O2↑+
O2↑+