题目内容
已知反应:2KClO3+4HCl=2KCl+Cl↑+2ClO2↑+2H2O,每生成1mol ClO2时转移的电子数为 个,每消耗1mol KClO3,产生的气体在标准状况下的体积为 L.
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:根据化合价变化分析电子情况,然后用双线桥法分析出电子转移的方向和数目,然后计算出生成1molClO2时转移电子的物质的量及数目;根据反应方程式计算出消耗1molKClO3产生气体的总物质的量,再根据V=nVm计算出标况下气体的体积.
解答:
解:KClO3中氯元素化合价由+5价降低为ClO2中+4价,HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,该反应转移2e-,电子转移的方向和数目为: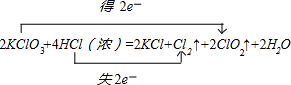 ,生成2molClO2转移了2mol电子,则生成1molClO2时转移电子的物质的量为:2×
,生成2molClO2转移了2mol电子,则生成1molClO2时转移电子的物质的量为:2×
mol=1mol,注意的电子数为NA;
根据反应方程式可知,消耗2mol氯酸钾会生成1molCl2、2molClO2,总共生成3mol气体,
则消耗1molKClO3生成气体的物质的量为:3mol×
=1.5mol,标况下1.5L气体的体积为:22.4L/mol×1.5mol=33.6L,
故答案为:NA;33.6.
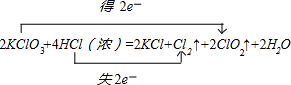 ,生成2molClO2转移了2mol电子,则生成1molClO2时转移电子的物质的量为:2×
,生成2molClO2转移了2mol电子,则生成1molClO2时转移电子的物质的量为:2×| 1 |
| 2 |
根据反应方程式可知,消耗2mol氯酸钾会生成1molCl2、2molClO2,总共生成3mol气体,
则消耗1molKClO3生成气体的物质的量为:3mol×
| 1 |
| 2 |
故答案为:NA;33.6.
点评:本题考查了氧化还原反应的有关计算、物质的量的计算,题目难度中等,正确分析氧化还原反应中电子转移情况为解答本题的关键,明确物质的量与气体摩尔体积、阿伏伽德罗常数之间关系为解答基础,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
已知下列氧化剂均能氧化+4价的硫(元素),为了除去稀硫酸中的亚硫酸,宜选用的氧化剂是( )
| A、氯气 | B、双氧水 |
| C、过氧化钠 | D、高锰酸钾 |
“西北通道”是指从北大西洋、经加拿大北极群岛进入北冰洋、再进入太平洋的航道,是连接大西洋和太平洋的捷径.最新卫星测量结果显示,北极冰层融化加速,“西北通道”有望在2020年通航,要比专家预测提前30年.提前通航的主要原因是( )
| A、二氧化碳增多使太阳辐射到地球表面的能量增多 |
| B、二氧化碳等气体能释放能量,使大气层的温度升高 |
| C、氟氯烃等大量排放,破坏臭氧层引起的 |
| D、二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
Fe,Zn和另一种金属组成的金属粉末10g与足量稀盐酸反应放出1g氢气,另一重金属可能是( )
| A、Mg | B、Al | C、Cu | D、Na |
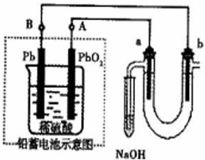 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)
用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)| A、铅蓄电池负极的反应式为:Pb-2e-=Pb2+ |
| B、铅蓄电池放电时,B极质量减轻,A极质量增加 |
| C、铅蓄电池充电时,A极应与外电源负极相连 |
| D、电解苦卤水时,a电极首先放电的是Br- |
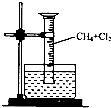 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题: