题目内容
17.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.015 mol/(L•s) | ||
| C. | v(C)=0.40 mol/(L•min) | D. | v(D)=0.45 mol/(L•min) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位要一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,
A.$\frac{v(A)}{1}$=0.15mol/(L•min);
B.v(B)=0.015 mol/(L•s)=0.9 mol/(L•min),$\frac{v(B)}{3}$=0.3 mol/(L•min);
C.$\frac{v(C)}{2}$=0.20 mol/(L•min);
D.$\frac{v(D)}{2}$=0.225 mol/(L•min);
故反应速率v(B)>v(D)>v(C)>v(A),
故选B.
点评 本题考查化学反应速率快慢比较,难度不大,利用比值法可以迅速判断,也可以转化为同一物质表示的速率进行比较.

练习册系列答案
相关题目
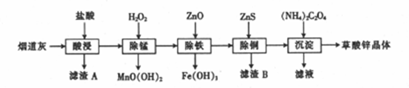
8.以炼锌厂的烟道灰如图(主要成分为ZnO,还含有少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O).
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
已知:Ksp(FeS)=1.4×10-39,Ksp(MnS)=1.4×10-13.
(1)滤渣A的主要成分为SiO2(填化学式).
(2)生成滤渣B的离子方程式为ZnS+Cu2+=CuS+Zn2+.
(3)除铁时加入ZnO控制反应液的pH范围为3.3~5.4.
(4)该炼锌厂废气中含有H2S,可用FeCl3溶液吸收H2S,得到单质硫,过滤后,再以石墨为电极,在一定条件下电解滤液.
①FeCl3与H2S反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+.
②电解池中阴极的电极反应式为2H+-2e-=H2↑.
(5)25℃时,向0.10mol•L-1的H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH与c(S2-)的关系如图2所示(忽略溶液体积的变化和H2S的挥发)
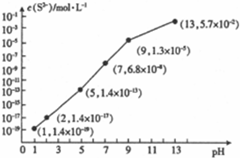
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1
②某溶液中含未知浓度的Mn2+、0.01mol•L-1Fe2+和0.10mol•L-1H2S,当溶液pH=2时,Fe2+ 开始沉淀,当Mn2+开始沉淀时,溶液中
$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2×106.

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2(填化学式).
(2)生成滤渣B的离子方程式为ZnS+Cu2+=CuS+Zn2+.
(3)除铁时加入ZnO控制反应液的pH范围为3.3~5.4.
(4)该炼锌厂废气中含有H2S,可用FeCl3溶液吸收H2S,得到单质硫,过滤后,再以石墨为电极,在一定条件下电解滤液.
①FeCl3与H2S反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+.
②电解池中阴极的电极反应式为2H+-2e-=H2↑.
(5)25℃时,向0.10mol•L-1的H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH与c(S2-)的关系如图2所示(忽略溶液体积的变化和H2S的挥发)

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1
②某溶液中含未知浓度的Mn2+、0.01mol•L-1Fe2+和0.10mol•L-1H2S,当溶液pH=2时,Fe2+ 开始沉淀,当Mn2+开始沉淀时,溶液中
$\frac{c(M{n}^{2+})}{c(F{e}^{2+})}$=2×106.
5.下列反应的离子反应方程式书写正确的是( )
| A. | 向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液:2I-+H2O2═I2+2OH- | |
| B. | 在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-═Cl-+2H++SO42- | |
| C. | 向Ba(OH)2溶液中加入过量NH4HSO4:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+═2Fe3++3H2O |
12.室温时,将同种规格的铝片分别投入下列物质中,生成氢气的反应速率最大的是( )
| A. | 0.1mol/L盐酸15mL | B. | 0.2mol/L盐酸12mL | ||
| C. | 0.15mol/L硫酸8mL | D. | 浓硫酸15mL |
2.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.Y的核电荷数是Z的核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | X、Y、M三种元素可形成离子化合物 | |
| C. | 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 | |
| D. | Z元素的最高价氧化物的水化物的化学式为HZO4 |
9.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 小苏打--Na2CO3 | B. | 消石灰--Ca (OH)2 | C. | 甲醛--CH3OH | D. | 大理石--CaSO4 |
7.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由物质本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明:在其它条件相同时,温度对反应速率有影响.
(2)我们最好选取实验1、2、4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大,反应速率越快.
(3)利用表中数据,可以求得:硫酸的物质的量浓度是2_mol/L.
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 2.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 2.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 2.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2、4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大,反应速率越快.
(3)利用表中数据,可以求得:硫酸的物质的量浓度是2_mol/L.