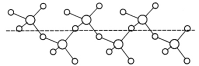
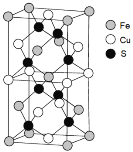
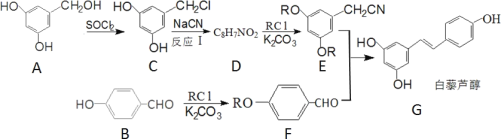
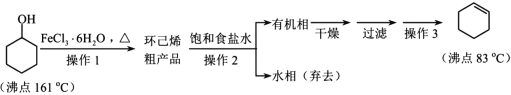
题目内容
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至 Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mLB.120mLC.240mLD.360mL
【答案】B
【解析】
Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2,故可以通过O2的量来计算参加反应的Cu的量,也可以计算出生成的Cu2+的量,从而计算得NaOH的体积。
Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2;n(O2)=![]() =0.15mol,则转移电子0.6mol,故可以有0.3mol Cu参加反应,即生成0.3mol Cu2+,则需要0.6mol NaOH形成沉淀,故V(NaOH)=
=0.15mol,则转移电子0.6mol,故可以有0.3mol Cu参加反应,即生成0.3mol Cu2+,则需要0.6mol NaOH形成沉淀,故V(NaOH)=![]() =0.12L=120mL,故选B。
=0.12L=120mL,故选B。

 阅读快车系列答案
阅读快车系列答案【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___点(选填“D”、“E”或“F”)。
(3)已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
该反应是____反应(填“吸热反应”或“放热反应”);反应初始至平,A的平均反应速率v(A)=_____。达到平衡后,B的转化率为____。